 Hay muchas clases distintas de proteínas. La lista que sigue, aunque incompleta, contiene la mayor parte de las funciones biológicas importantes de las proteínas.
Hay muchas clases distintas de proteínas. La lista que sigue, aunque incompleta, contiene la mayor parte de las funciones biológicas importantes de las proteínas.
1. Muchas proteínas actúan como enzimas, los catalizadores bioquímicos. Las enzimas catalizan casi todas las reacciones que suceden en los organismos vivos.
2. Algunas proteínas se unen con otras moléculas para su almacenamiento y transporte. Por ejemplo, la mioglobina se enlaza con el oxígeno en las células de los músculos esquelético y cardiaco, mientras que la hemoglobina se une y transporta al O2 y al CO2 en los glóbulos rojos.
3. Algunas proteínas, como la tubulina, actina y colágena, proporcionan soporte y forma a las células, y en consecuencia a los tejidos y los organismos.
4. Los conjuntos de proteínas pueden efectuar trabajo mecánico, como el movimiento de flagelos, la separación de cromosomas en la mitosis y la contracción de los músculos.
5. Muchas proteínas desempeñan un papel en la descodificación de la información celular. Algunas intervienen en la traducción, mientras que otras juegan un papel en la regulación de la expresión genética al unirse a los ácidos nucleicos.
6. Algunas proteínas son hormonas que regulan las actividades bioquímicas en las células o los tejidos blancos; otras proteínas sirven como receptores de las hormonas.
7. Algunas proteínas desarrollan funciones muy especializadas. Por ejemplo, los anticuerpos defienden a los vertebrados contra infecciones bacterianas y víricas, y las toxinas, que producen algunas bacterias, matan organismos mayores.
Estructura general de los aminoácidos
 Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos comunes, estándar o normales.
Todos los organismos emplean los mismos 20 aminoácidos como bloques constructivos para armar las moléculas de proteína. A estos 20 aminoácidos se les llama aminoácidos comunes, estándar o normales.
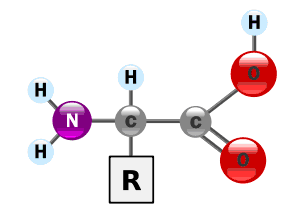
En los 20 aminoácidos comunes, los grupos amino y carboxilo están unidos al mismo átomo de carbono: el átomo de carbono a. Así, todos los aminoácidos estándar que contienen las proteínas son a-aminoácidos. Al carbono a se unen otros dos sustituyentes: un átomo de hidrógeno y una cadena lateral (R) que es única para cada aminoácido. En el intervalo fisiológico de pH, que es de 6.8 a 7.4, los aminoácidos son zwitteriones, o iones dipolares, aunque su carga neta pueda ser cero.
En 19 de los 20 aminoácidos que se usan en la biosíntesis de proteínas, el átomo de carbono a es quiral, o asimétrico, porque tiene cuatro grupos diferentes unidos a él. La excepción es la glicina, cuyo grupo R sólo es un átomo de hidrógeno (la molécula no es quiral, porque el átomo de carbono a está unida a dos átomos idénticos de hidrógeno). Los 19 aminoácidos quirales pueden, en consecuencia, existir como estereoisómeros. Los estereoisómeros son compuestos que tienen la misma fórmula molecular pero difieren en el orden o configuración de sus átomos en el espacio. Los dos estereoisómeros son moléculas distintas que no se pueden interconvertir con facilidad entre sí ya que un cambio de configuración requiere romper uno o más enlaces. Los estereoisómeros de aminoácidos no son imágenes especulares (es decir, imágenes en espejo) superponibles; a dichos estereoisómeros se les llama enantiómeros.
Los 19 aminoácidos quirales con los que se ensamblan las proteínas presentan la configuración L, aunque en la naturaleza se encuentran unos pocos D-aminoácidos.
Estructuras de los 20 aminoácidos comunes
En las proyecciones de Fischer, los enlaces horizontales en un centro quiral se extienden hacia el espectador y los verticales se alejan. Algunas cadenas laterales son no polares, y en consecuencia hidrofóbicas, mientras que otras son polares o ionizadas a pH neutro y en consecuencia son hidrofílicas.
En las figuras se usan las abreviaturas de tres y de una letra para indicar cada aminoácido. La abreviatura de tres letras es evidente (en inglés), pero la abreviatura simple de una letra es menos obvia. Varios aminoácidos comienzan con la misma letra, de modo que se deben usar otras letras del alfabeto para tener una designación adecuada; por ejemplo, treonina T, tirosina Y y triptófano W. Estos identificadores se deben memorizar.
Las cadenas laterales pertenecen a las siguientes clases químicas: alifática, aromática, sulfurada, alcohol, base, ácido y amida. De los 20 aminoácidos, cinco se subdividen en muy (o altamente) hidrofóbicos (en gris claro) y siete se clasifican como muy hidrofílicos (en negro). Comprender la clasificación de los grupos R simplificará la memorización de las estructuras y los nombres.
A. Grupos R alifáticos
La glicina (Gly, G) es el aminoácido más pequeño porque su grupo R no es más que un átomo de hidrógeno; en consecuencia, el carbono a de la glicina no es quiral. Los dos átomos de hidrógeno del carbono ade la glicina imparten poco carácter hidrofóbico a la molécula.
La valina, leucina e isoleucina se conocen como aminoácidos de cadena ramificada porque sus cadenas laterales de átomos de carbono contienen ramificaciones. Los tres aminoácidos son muy hidrofóbicos. La prolina (Pro, P) difiere de los 19 aminoácidos porque su cadena lateral de tres carbonos está unida al nitrógeno de su grupo a-amino y también al carbono a formando una molécula cíclica. . La estructura cíclica de la prolina la vuelve mucho menos hidrofóbica que valina, leucina e isoleucina.
La fenilalanina (Phe, F), tirosina (Tyr, Y) y el triptófano (Trp, W) presentan cadenas laterales con grupos aromáticos. En el caso de la fenilalanina es una cadena hidrofóbica bencílica. La tirosina se parece estructuralmente a la fenilalanina; en la tirosina, un grupo hidroxilo sustituye al hidrógeno para de la fenilalanina lo que la convierte en un fenol. El grupo hidroxilo de la tirosina es ionizable, pero bajo condiciones fisiológicas normales retiene su hidrógeno. La cadena lateral del triptófano contiene un grupo indol bicíclico. La tirosina y el triptófano no son tan hidrofóbicos como la fenilalanina porque en sus cadenas laterales hay grupos polares.
Los aromáticos contienen electrones p deslocalizados. A pH neutro tanto el triptófano como la tirosina absorben luz a una longitud de onda de 280 nm, mientras que la fenilalanina es casi transparente a 280 nm y absorbe débilmente luz a 260 nm.
C. Grupos R sulfurados
La metionina (Met, M) y la cisteína (Cys, C) son los dos aminoácidos azufrados. La metionina contiene un grupo tioéter metilo, no polar, en su cadena lateral, lo que la convierte en uno de los aminoácidos más hidrofóbicos. La metionina desempeña un papel especial en la síntesis de proteínas porque casi siempre representa el primer aminoácido en una cadena de polipéptido. La estructura de la cisteína se parece a la de la alanina, con un átomo de hidrógeno reemplazado por un grupo sulfhidrilo (-SH).
D. Cadenas laterales con grupos alcohol
La serina (Ser, S) y la treonina (Thr, T) tienen cadenas laterales polares sin carga que contienen grupos b-hidroxilo. Estos grupos alcohol dan carácter hidrofílico a las cadenas laterales alifáticas.
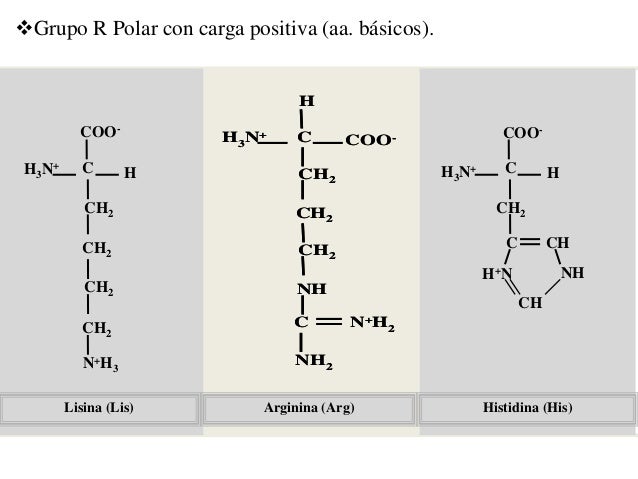
E. Grupos R básicos
La histidina (His, H), lisina (Lys, K) y arginina (Arg, R) presentan cadenas laterales hidrofílicas que son bases nitrogenadas y tienen carga positiva a pH 7. La cadena lateral de la histidina contiene un sustituyente de anillo de imidazol. La arginina es el más básico de los 20 aminoácidos porque su cadena lateral de ion guanidinio está protonada bajo todas las condiciones que se encuentran de manera habitual dentro de una célula. Las cadenas laterales de arginina también aportan cargas positivas a las proteínas.
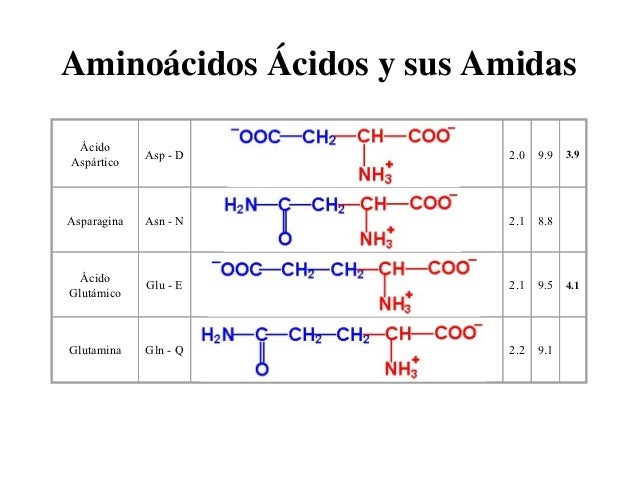
F. Grupos R ácidos y sus amidas derivadas
El aspartato (Asp, D) y el glutamato (Glu, E) son aminoácidos dicarboxílicos y tienen cadenas laterales hidrofílicas con carga negativa a pH 7. Además de los grupos carboxilo a, el aspartato posee un grupo carboxilo b y el glutamato un grupo carboxilo g. El aspartato y el glutamato confieren carga negativa a las proteínas porque sus cadenas laterales se encuentran ionizadas a pH 7. A veces se les llama ácido aspártico y ácido glutámico.
La asparagina (Asn, N) y la glutamina (Gln, Q) son las amidas del ácido aspártico y el ácido glutámico, respectivamente. Aunque las cadenas laterales de la asparagina y la glutamina son eléctricamente neutras, estos aminoácidos son muy polares.
G. Hidrofobicidad de las cadenas laterales de aminoácidos
Hay varias formas de medir la hidropatía, pero la mayor parte de ellas se basa en calcular la tendencia del desempeño de un aminoácido en un ambiente hidrofóbico o uno hidrofílico. Una escala de hidropatía que se usa con frecuencia se muestra en la tabla 3.1. Los aminoácidos con valores de hidropatía muy positivos se consideran hidrofóbicos, mientras que aquellos con los mayores valores negativos se consideran hidrofílicos.
La hidropatía es un determinante importante del plegamiento de cadenas de proteína porque las cadenas laterales hidrofóbicas tienden a estar agrupadas en el interior de una proteína y los residuos hidrofílicos en general se encuentran en la superficie.
Ionización de los aminoácidos
Cada grupo ionizable guarda relación con un valor específico de pKa, que corresponde al pH al que son iguales las concentraciones de las formas protonada y no protonada. Cuando el pH de la solución es menor que el pKa, predomina la forma protonada y el aminoácido es entonces un ácido real, capaz de donar un protón. Cuando el pH de la solución es mayor que el pKa del grupo ionizable, la forma no protonada de ese grupo predomina, y el aminoácido existe en forma de base conjugada, que es aceptora de protones.
El pKa de un grupo ionizable corresponde a un punto medio en su curva de titulación. Es el pH al cual la concentración de la forma ácida (donador de protones) es exactamente igual a la concentración de su base conjugada (aceptor de protones).
Bajo condiciones fisiológicas, el grupo amino a está casi todo protonado y con carga positiva. Estos cálculos comprueban una afirmación anterior, que los aminoácidos libres existen principalmente en forma de zwitteriones a pH neutro.
Los siete aminoácidos estándar con grupos fácilmente ionizables en sus cadenas laterales son aspartato, glutamato, histidina, cisteína, tirosina, lisina y arginina.
Los pKa
Los valores de pKa de las cadenas laterales ionizables en las proteínas pueden ser distintos de los aminoácidos libres. Hay dos factores que causan esta perturbación de constantes de ionización. El primero es que los grupos a-amino y a-carboxilo pierden sus cargas una vez enlazados por uniones peptídicas en las proteínas; en consecuencia, ejercen efectos inductivos más débiles sobre sus cadenas laterales vecinas. El segundo es que la posición de una cadena lateral ionizable dentro de la estructura tridimensional de una proteína puede afectar su pKa.
Unión de aminoácidos por enlaces peptídicos en las proteínas
- Estructura Primaria
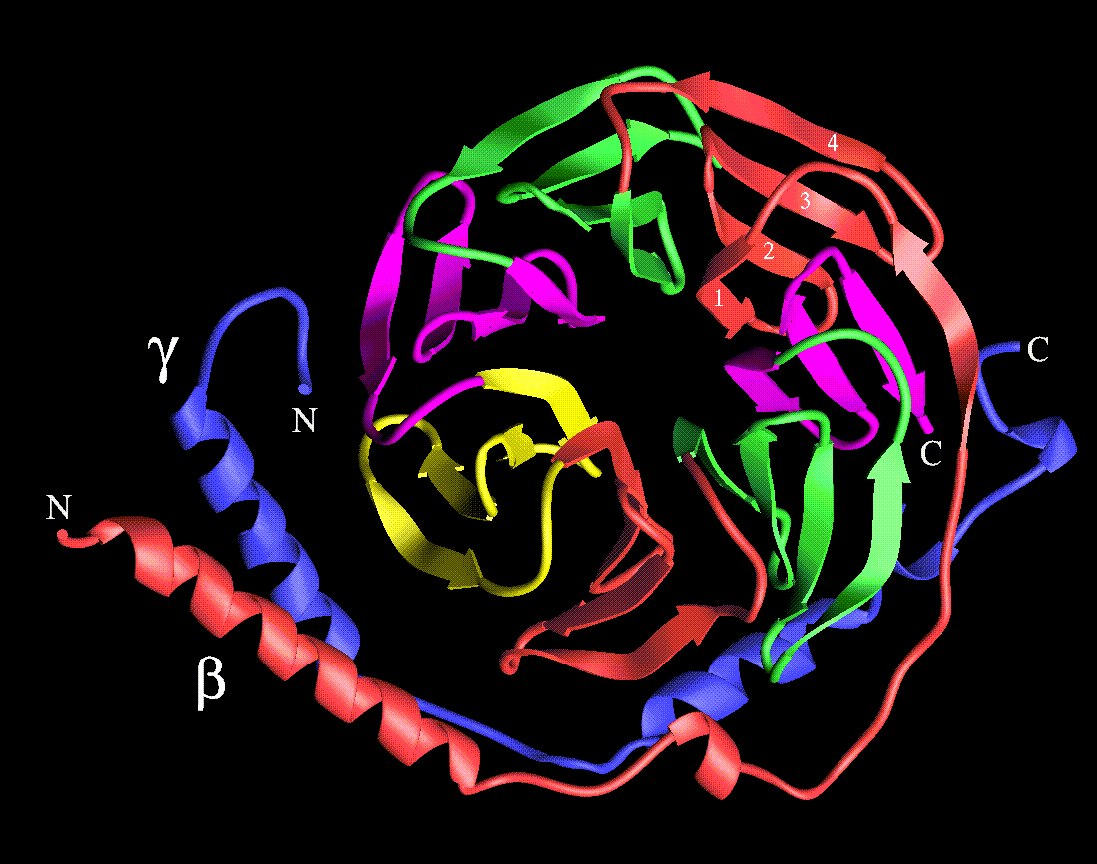
La secuencia lineal de aminoácidos en una cadena polipeptídica se llama estructura primaria de una proteína. A los niveles más altos de estructura se les llaman estructura secundaria, terciaria y cuaternaria.
El enlace que se forma entre los aminoácidos es un enlace de amida y se llama enlace peptídico, o enlace de péptido. Esta unión se puede concebir como el resultado de una condensación simple del grupo carboxilo a de un aminoácido con el grupo amino a del otro. Observe que se pierde una molécula de agua de los aminoácidos que se condensan en la reacción. Los grupos que intervienen en los enlaces peptídicos no tienen cargas iónicas.
El grupo amino libre y el grupo carboxilo libre en los extremos opuestos de una cadena de péptido se llaman N-terminal (o terminal N, terminal amino) y C-terminal (o terminal C, terminal carboxilo), respectivamente. Por convención, los residuos de aminoácido en una cadena peptídica se numeran desde el N-terminal hasta el C-terminal.
Técnicas de purificación de las proteínas
Los pasos de purificación suelen aprovechar pequeñas diferencias en las solubilidades, cargas netas, tamaños y especificidades de unión de las proteínas. La mayor parte de las técnicas de purificación se lleva a cabo entre 0 y 4°C para minimizar los procesos dependientes de la temperatura, como la degradación y la desnaturalización (desdoblado) de la proteína.
El primer paso en la purificación de una proteína es preparar una solución de proteínas. El aislamiento de una proteína intracelular requiere suspender las células en una solución amortiguadora y homogeneizarlas o romperlas en fragmentos de célula.
El siguiente paso de la purificación es, con frecuencia, una relativamente separación cruda, o fraccionamiento, procedimiento que aprovecha las distintas solubilidades de las proteínas en soluciones salinas. Con frecuencia se usa sulfato de amonio en esos fraccionamientos. Se mezcla suficiente sulfato de amonio con la solución de proteínas para precipitar a las impurezas menos solubles, que se eliminan por centrifugación. El fraccionamiento con sulfato de amonio obtiene una purificación del doble al triple (es decir, de la mitad a dos terceras partes de las proteínas no deseadas se eliminan de la fracción que resulta, de proteína enriquecida). . En la diálisis, se coloca una solución de la proteína en un cilindro de tubo de celofán sellado en un extremo. A continuación el tubo se sella en el otro extremo y se suspende dentro de un gran volumen de solución amortiguadora. La membrana de celofán es semipermeable: las proteínas de alto peso molecular son demasiado grandes para atravesar por los poros de la membrana, de manera que las proteínas permanecen dentro del tubo, mientras que los solutos de bajo peso molecular (incluyendo, en este caso, los iones de amonio y sulfato) se difunden y salen para ser reemplazados por los solutos de la solución amortiguadora.
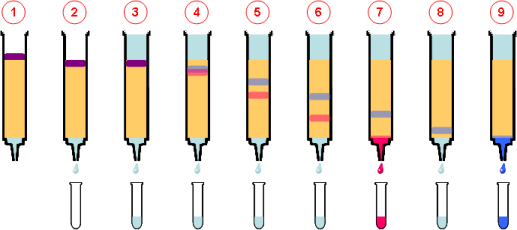
La cromatografía en columna para fraccionar la mezcla de proteínas que resta después de la precipitación con sulfato de amonio y la diálisis. Una columna cilíndrica se llena con un material insoluble, como fibras de celulosa sustituida o esferillas de material sintético. La mezcla de proteínas se agrega a la columna y se lava haciendo pasar por la matriz de material insoluble un solvente. A medida que el solvente fluye por la columna, el eluido (que es el líquido que sale por el fondo de la columna) se recolecta en muchas fracciones. La velocidad con la que las proteínas atraviesan la matriz depende de las interacciones entre matriz y proteína. La velocidad con la que las proteínas atraviesan la matriz depende de las interacciones entre matriz y proteína.
Las técnicas cromatográficas se clasifican de acuerdo con el tipo de matriz. entre ellas estan:
- En la cromatografía de intercambio iónico
- La cromatografía por filtración en gel
- La cromatografía de afinidad




No hay comentarios:
Publicar un comentario