Lípidos
 Los lípidos son biomoléculas
orgánicas formadas principalmente por,
Carbono e Hidrogeno y generalmente Oxigeno
Los lípidos son biomoléculas
orgánicas formadas principalmente por,
Carbono e Hidrogeno y generalmente Oxigeno
Son sustancias heterogéneas
que tienen en común varias características como el ser insolubles en agua, son
solubles en disolventes orgánicos como el éter, benceno, etc.
Están presentes en el tejido
de los animales (reserva de energía) y las plantas.
Existen diferentes tipos de
compuestos orgánicos en este caso lípidos como son: Ácidos de alta masa
molecular, (denominados ácidos grasos) Ceras, Triglicéridos, Fosfolípidos, Glucolípidos,
Terpenos, Terpenoides, Esteroles y Esteroides.
Una característica básica de los lípidos, y de
la que derivan sus principales propiedades biológicas es la hidrofobicidad, con
gran cantidad de enlaces C-H y C-C. La naturaleza de estos enlaces es
100% covalente y su momento dipolar es mínimo. El agua, al ser una molécula muy
polar, con gran facilidad para formar puentes de hidrógeno, no es capaz de
interaccionar con estas moléculas.
Las grasas o lípidos en el
organismo humano sirven como depósitos de energía, como protección de los
órganos, aislamiento del frío, transporte de las vitaminas liposolubles
disueltas en las grasas y para aportar ácidos grasos esenciales. El cuerpo humano necesita de
las grasas para poder realizar la síntesis de ciertas hormonas como la
testosterona.
Ácidos grasos: Son los lípidos más simples y tienen la fórmula general R—COOH, donde R representa una cadena de hidrocarburo. Los ácidos grasos son componentes de muchos tipos más complejos de lípidos, incluyendo los triglicéridos o triacilgliceroles, los glicerofosfolípidos y los esfingolípidos. En varias especies se han identificado más de 100 ácidos grasos distintos. Los ácidos grasos difieren entre sí en la longitud de sus colas de hidrocarburo, la cantidad de dobles enlaces carbono-carbono, las posiciones de los dobles enlaces en las cadenas y la cantidad de ramificaciones.
Fosfolípidos: Lípido con grupos fosfato
Glicoesfingolípidos:Lipidos que tienen grupos esfingosina y carbohidrato a la vez
Isoprenoides: Son los esteroides, las vitaminas lipídicas y los terpenos se relacionan
con la molécula de isopreno, de cinco carbonos.
Ácidos grasos No saturados o insaturados: Los ácidos grasos que tienen al menos un doble enlace carbono-carbono.
Monoinsaturados: Los ácidos grasos no
saturados que sólo tienen un doble enlace carbono-carbono.
Poliinsaturado: Los ácidos grasos no
saturados que los que tienen dos o más doble enlace carbono-carbono.
Triacilgliceroles o triglicéridos: Son los ácidos grasos que se almacenan en forma de lípidos neutros, están formados por tres residuos de acilo graso
esterificados con glicerina, un azúcar alcohol de tres carbonos. Como indica su nombre, los triacilgliceroles están formados por tres residuos de acilo graso esterificados con glicerina, un azúcar alcohol de tres carbonos. Los triacilgliceroles son muy hidrofóbicos. En consecuencia, a diferencia de otros carbohidratos, se pueden almacenar en células en forma anhidra, esto es, las moléculas no están solvatadas por agua, lo cual ocuparía espacio y añadiría masa, reduciendo la eficiencia del almacenamiento de energía.
Glicerofosfolípidos: Son los lípidos más abundantes en la mayor parte de las membranas, como los triacilgliceroles tienen un soporte de glicerol. Los glicerofosfolípidos más sencillos, los fosfatidatos, consisten en dos grupos acilo graso esterificados en el C-1 y C-2 del 3-fosfato de glicerol (tabla 9.2). Nótese que hay tres grupos acilo graso esterificados con la glicerina en los triacilgliceroles, en tanto que sólo hay dos grupos acilo graso (R1 y R2) en los glicerofosfolípidos. La propiedad distintiva de los grupos acilo (R1 y R2) de los glicerofosfolípidos es la presencia de un grupo fosfato en el C-3 del soporte del glicerol. Las estructuras de los glicerofosfolípidos se pueden dibujar como derivados del L-glicerol 3-fosfato (o 3-fosfato de L-glicerol), con el sustituyente en el C-2 a la izquierda en una proyección de Fischer, como en la tabla 9.2. Para simplificar, con frecuencia se mostrarán esos compuestos como estructuras no referidas a su estereoquímica.
Esfingolípidos: Son los lípidos más abundantes en las membranas vegetales y animales. En los mamíferos tienen abundancia especial en tejidos del sistema nervioso central. La mayor parte de las bacterias no tienen esfingolípidos. El respaldo estructural de los esfingolípidos es la esfingosina (trans-4-esfingenina), un alcohol no ramificado de C18, con un doble enlace trans entre el C-4 y C-5, un grupo amino en el C-2 y grupos hidroxilo en el C-1 y C-3 (figura 9.10a).
Ceramida: Está formada por un grupo acilo graso unido al grupo amino del C-2 en la
esfingosina, por un enlace de amida (figura 9.10b). Las ceramidas son los precursores metabólicos de todos los esfingolípidos. Las tres grandes familias de esfingolípidos son las esfingomielinas, los cerebrósidos y los gangliósidos. De ellos, sólo las esfingomielinas contienen fosfato, y se clasifican como fosfolípidos; los cerebrósidos y los gangliósidos contienen residuos de carbohidrato y se clasifican como glicoesfingolípidos.
Esfingomielinas: La fosfocolina está unida al grupo hidróxido en el C-1 de una ceramida,
existen en las membranas plasmáticas de la mayor parte de las células de
mamíferos, y son componente principal de las vainas de mielina que rodean a
ciertas células nerviosas.
Cerebrósidos: Son glicoesfingolípidos que contienen un residuo de monosacárido unido a
un enlace b-glicosídico al C-1 de una ceramida.
Gangliósidos: Son glicoesfingolípidos más complejos, donde las cadenas de
oligosacárido que contienen ácido N-acetilneuramínico (NeuNAc) están unidas a
una ceramida.
Esterol: El colesterol es un esterol porque tiene un grupo hidroxilo en el C-3.
Otros esteroides son los de las plantas, hongos y las hormonas esteroides de
mamíferos (como estrógenos, andrógenos, progestinas y corticosteroides
suprarrenales), y las sales biliares.
Eicosanoides: Son derivados oxigenados de ácidos grasos poliinsaturados de C20, como
ácido araquidónico. En la figura 9.18 se presentan algunos ejemplos de eicosanoides. Éstos participan en una diversidad de procesos fisiológicos, y también pueden mediar muchas respuestas potencialmente patológicas. Las Prostaglandinas: Son eicosanoides que tienen un anillo de ciclopentano.
Bicapas lipídicas: Son el principal componente estructural de todas las membranas
biológicas, incluyendo membranas plasmáticas y membranas internas de células
eucariotas.
Modelo de mosaico fluido: Según el modelo del mosaico fluido, la membrana es una estructura dinámica en la que se pueden difundir lateralmente o girar dentro de la bicapa, en forma rápida y aleatoria, las proteínas y los lípidos. Las proteínas de membrana se conciben como témpanos de hielo flotando en un mar muy fluido de bicapa lipídica.
Microscopia electrónica de criofractura: Con esta técnica se puede visualizar la distribución de las proteínas de
membrana.
Balsas de lípido: El colesterol tiende a asociarse con los esfingolípidos, porque tienen
largas cadenas de ácido graso saturado. Las cadenas no saturadas de la mayor
parte de los glicerofosfolípidos producen arrugas que no admiten con facilidad
moléculas de colesterol en la membrana. Las membranas de mamíferos están
formadas por parches de regiones de colesterol/esfingolípido, rodeadas por
regiones que tienen muy poco colesterol.
Las proteínas integrales de membrana, llamadas también proteínas
transmembranales: Contienen regiones hidrofóbicas incrustadas en el interior hidrofóbico
de la bicapa lipídica. Las proteínas integrales de membrana abarcan totalmente
a la bicapa con una parte de la
proteína expuesta sobre la superficie externa, y una parte expuesta en la superficie
interna. Algunas proteínas integrales de membrana están ancladas sólo por una parte de la cadena del polipéptido que abarca la
membrana. Otras proteínas de membrana tienen varios segmentos unidos por bucles
en la superficie de la membrana.
Las proteínas periféricas de membrana: Se asocian a una cara de la membrana, mediante interacciones de carga a
carga y con puentes de hidrógeno, con las proteínas integrales de membrana o
con los grupos de cabeza polar de los lípidos de membrana.
Las proteínas de
membrana ancladas a lípidos: Están unidas a una membrana mediante un enlace covalente con un ancla
lipídico. En las proteínas de membrana ancladas a lípidos más simples, una
cadena lateral de aminoácidos se une por un enlace de amida o de éster a un
grupo de acilo graso, con frecuencia de miristato o palmitato.
Proteínas preniladas: son proteínas de membrana ancladas a lípidos están enlazadas en forma
covalente a una cadena isoprenoide (de 15 o de 20 carbonos) a través del átomo
de azufre de un residuo de cisteína en el término C de la proteína, o cerca de éste. Estas proteínas preniladas se encuentran en la cara citoplásmica
de membranas tanto plasmáticas como intracelulares.
Transporte de Membrana
Los poros y los canales: Son proteínas transmembranales con un paso central para iones y
moléculas pequeñas.
Simporte: Muchos transportadores hacen
el transporte simultáneo de dos moléculas de diferentes solutos. Si ambas
moléculas se transportan en la misma dirección se llama simporte.
Antiporte: Es el proceso donde dos moléculas se transportan en direcciones opuestas.
Transporte Activo: El transporte activo se parece al transporte pasivo en el mecanismo y
propiedades cinéticas generales. Sin embargo, el transporte activo requiere
energía para mover un soluto contra su gradiente de concentración. En algunos
casos, el transporte activo de moléculas o iones cargados causa también un
gradiente de carga a través de la membrana, y el transporte activo mueve los
iones contra el potencial de membrana.
- Transporte activo primario: Está activado por una fuente directa de energía, como ATP o luz. Es la P-glicoproteína, que parece tener un papel principal en la resistencia de las células tumorales a varios medicamentos de quimioterapia. La función fisiológica normal de la P-glicoproteína al parecer es la eliminación de compuestos hidrofóbicos tóxicos en la dieta.
- Transporte activo secundario: Está impulsado por un gradiente de concentración. El transporte cuesta arriba activo de un soluto se acopla con el transporte cuesta abajo de un segundo soluto que estaba concentrado por el transporte activo primario.
Endocitosis: En las células eucariotas, aunque no en todas, las proteínas (y ciertas
sustancias grandes) se mueven hacia adentro de la célula.
Exocitosis: En las células eucariotas, aunque no en todas, las proteínas (y ciertas
sustancias grandes) se mueven hacia afuera de la célula.
Traducción de señales extracelulares:
Quimiotaxia: En las membranas plasmáticas de todas las células contienen receptores
específicos que permiten que la célula responda a estímulos químicos externos
que no pueden cruzar la membrana.
Hormonas: Son moléculas que permiten que las células en una parte de un organismo
se comuniquen con las de otra parte del mismo organismo.
Neurotransmisores: Son sustancias que transmiten mensajes nerviosos en las sinapsis.
Factores de crecimiento: Son proteínas que regulan la proliferación celular.
Transductor: Es una proteína de membrana donde pasa una señal hasta una enzima
efectora.
Enzima efectora: Esta enlazada a la membrana, es la que recibe la señal enviada por la
interacción del ligando con su receptor.
Segundo mensajero: Se genera por la acción de la enzima efectora que suele ser una molécula o ion pequeño. El
segundo mensajero se puede difundir y conduce la señal hacia su destino final,
que puede estar en el núcleo, en un compartimiento intracelular o en el
citosol.
Cascada: La amplificación es una propiedad importante de las rutas de
señalización. Un solo complejo ligando-receptor puede interactuar con varias
moléculas de transductor, y cada una de ellas puede activar varias moléculas de
enzima efectora. De igual modo, la producción de muchas moléculas de segundo
mensajero puede activar a muchas moléculas de cinasa, que catalizan la
fosforilación de muchas proteínas.
Proteina G: Actúan como transducores, agentes que transmiten estimulos externos a enzimas efectoras. Las proteínas G tienen actividad de GTPasa; esto es, catalizan lentamente la hidrólisis de 5’-trifosfato de guanosina (GTP, el análogo de guanina del ATP) para formar 5’-difosfato de guanosina (GDP). Cuando el GTP está unido a una proteína G está activo para transducción de señal, y cuando el GDP está unido a una proteína G está inactivo.
Usos de los Lipídos en la Farmacia
Las grasas, los aceites fijos y algunos ácidos grasos
insaturados son alimentos esenciales. Su ausencia en la dieta humana ha
producido condiciones eczematosa en la piel.
Existen evidencias experimentales de grasas como el aceite de azafrán, que son ricos en ácido linoleico y otros ácidos insaturados y juegan un importante rol en la movilización del colesterol cuando se utiliza de forma razonable en la dieta.
Algunos aceites como el de cacahuete y el aceite de sésamo son muy usados en la preparación de inyecciones intramusculares. Otros tienen acción medicinal por si mismo, como el aceite de castor (catártico), aceite de hígado de bacalao (anticatártico) y el aceite de oliva (emoliente).
La vitamina D, calciferol o antirraquítica es un
heterolípido insaponificable del grupo de los esteroides. Se le llama también
vitamina antirraquítica ya que su deficiencia provoca raquitismo.
Existen evidencias experimentales de grasas como el aceite de azafrán, que son ricos en ácido linoleico y otros ácidos insaturados y juegan un importante rol en la movilización del colesterol cuando se utiliza de forma razonable en la dieta.
Algunos aceites como el de cacahuete y el aceite de sésamo son muy usados en la preparación de inyecciones intramusculares. Otros tienen acción medicinal por si mismo, como el aceite de castor (catártico), aceite de hígado de bacalao (anticatártico) y el aceite de oliva (emoliente).
Ácido Undecilénico: es el ácido 10-undecenoico, un
compuesto no saturado de 11 carbonos. Los preparados de ácido undecilénico se
utilizan para tratar diversas dermatomicosis, en particular la tiña de los
pies.
Presentaciones: El ácido undecilénico, se distribuye en
presentaciones de espuma, pomada, crema, polvo o talco, polvo en aerosol, jabón
y líquido. El ácido undecilénico se expende en combinación con otros
ingredientes como el undecilenato de zinc. El zinc posee acción astringente y
mejora la supresión de la inflamación. La pomada compuesta de ácido
undecilénico contiene el ácido en cuestión (5% en promedio) y el undecilenato
de zinc (en promedio 20%).
Indicaciones Terapéuticas:Es un antimicótico indicado en
padecimientos causados por dermatofitos, levaduras y mohos, como las
dermatomicosis agudas y crónicas, dermatofitosis y micosis superficiales. Sus
principales indicaciones son: Tiña pedis (pie de atleta), micosis de pliegues
cutáneos, micosis interdigitales. El complejo aluminio-zirconio le confiere un
efecto antiperspirante y antiodorante, comúnmente presentes en el pie de
atleta.
Dosis y vía de administración: Cutánea.
Una vez que se manifiesta la infección, aplicar sobre la región afectada MICOTEX® Crema (especial cuidado en los pliegues interdigitales), previa limpieza, 2 veces al día por un período de 7 a 10 días. Para prevenir la infección por tiña pedis, aplicar conjuntamente Micotex® Polvo en el interior de calcetines y zapatos.
- Mesigyna inyectable
Composición:
1 ml de solución oleosa contiene: 5 mg de Valerato de Estradiol y 50 mg de
Enantato de Noretisterona.
Descripción:
Forma farmacéutica: Solución oleosa para inyección intramuscular (I.M.).
Indicaciones:
Anticoncepción hormonal.
Dosis: Una vez al mes o según no indicado por el médico.
Propiedades farmacodinámicas: Mesigyna protege contra el
embarazo principalmente al inhibir la ovulación y ocasionar cambios en el moco
cervical. El efecto que se ejerce sobre el endometrio es similar al de los
anticonceptivos orales combinados. Con el empleo de Mesigyna se obtiene un
patrón normal de hemorragia similar a la menstruación. En un amplio estudio
prospectivo de cohortes con 3 grupos se ha demostrado que la frecuencia de
diagnóstico de TEV oscila entre 8 y 10 por 10000 mujeres-año en las usuarias de
AOC de baja dosis de estrógenos (<50 µg de etinilestradiol).
- Vitamina D3
La vitamina D, calciferol o antirraquítica es un
heterolípido insaponificable del grupo de los esteroides. Se le llama también
vitamina antirraquítica ya que su deficiencia provoca raquitismo.
Composición: Cada cápsula blanda contiene 1.000 UI de Vitamina D3
Indicaciones: Tratamiento de las deficiencias orgánicas de Vitamina D,
prevención de las fracturas osteoporóticas y reducción de la pérdida ósea
pos-menopáusica
Molecula de la Vitamina D:
Dósis: 1 o 2 cápsulas / día
Contraindicaciones y advertencias: Hipersensibilidad a cualquiera de los componentes del
producto. Hipercalcemia e hipercalciuria
- Guayacolato de Glicerilo
Uso: El Guayacolato posee acción
expectorante y debido a que aumenta la producción de líquido a nivel del tracto
respiratorio, las secreciones se hacen menos viscosas facilitando su
eliminación por parte de los cilios. Es utilizado en el tratamiento sintomático
de la tos asociada al resfriado común, bronquitis, laringitis, faringitis y la
influenza. Su principal beneficio resulta en la habilidad de esta droga para
aflojar y licuar el esputo y las secreciones bronquiales al tiempo que facilita
su expectoración. Los expectorantes con Guayacolato de glicerilo son inocuos.
Composición: cada 100ml contiene: Guayacolato de Glicerilo 2.0g.
Composición: cada 100ml contiene: Guayacolato de Glicerilo 2.0g.
Excipientes c.s.p. 100ml
Indicaciones: Excelente opción en el manejo de la tos asociada al resfriado común.
Dosis:
Indicaciones: Excelente opción en el manejo de la tos asociada al resfriado común.
Dosis:
Niños de 2 a 6 años: 1
cucharadita (5ml) cada 4 horas.
Niños de 6 a 12 años: 1 y ½
cucharaditas (7,5ml) cada 4 horas.
Adultos y niños mayores de
12 años: 1 cucharada (15ml) cada 4 horas.
Contraindicaciones y advertencias: Hipersensibilidad al medicamento.
Contraindicaciones y advertencias: Hipersensibilidad al medicamento.
Otros derivados de la glicerina son los jabones y los
agentes de acción superficial (tensoactivos) los cuales se emplean como
detergentes y germicidas.
Los reinoides regulan de manera natural el crecimiento y la
diferenciación de gran variedad de células, y juegan un papel crucial en la
fisiología de la visión como agente morfogénico durante el desarrollo
embrionario. El ácido retinoico y sus derivados se usan normalmente para la
mitigación del los efectos del acné. El tocoferol es un nutriente esencial que
debe ser consumido en la dieta; se puede obtener a partir de la vitamina E que,
para fortuna de todos, se encuentra en gran cantidad de alimentos, principalmente
en aceites como el del canola, el de oliva y el de girasol, así como en algunas
frutas. Gran parte de los lípidos tiene propiedades exfoliantes y
antioxidantes; son los más demandados para los productos dermocosméticos que en
su gran mayoría deben tener estas cualidades.
Los lípidos en la medicina, sirven para hacer hormonas
artificiales como un ejemplo de este seria el colesterol que creamos en nuestro
cuerpo sirve para crear hormonas como los estrogenos en la mujer y la
testosterona en el hombre.
Ácidos Nucleicos
El descubrimiento, en 1869, de la sustancia que resultó ser ácido desoxirribonucleico (ADN) fue de Friedrich Miescher, joven médico suizo que trabajaba en el laboratorio de Felix Hoppe-Seyler, químico fisiólogo alemán. Miescher trató glóbulos blancos (contenidos en la pus de vendas quirúrgicas desechadas) con ácido clorhídrico para obtener núcleos para estudio. Cuando después se trataron los núcleos con ácido, se formó un precipitado que contenía carbono, hidrógeno, oxígeno y un alto porcentaje de fósforo. Miescher llamó “nucleína” al precipitado, porque provenía de núcleos. Después, cuando se vio que era fuertemente ácido, su nombre cambió a ácido nucleico. Aunque no lo supo, Miescher había descubierto el ADN. Poco después, Hoppe-Seyler aisló una sustancia parecida de las células de levadura. Hoy se sabe que esa sustancia es ácido ribonucleico (ARN). Tanto ADN como ARN son polímeros de nucleótidos, o polinucleótidos.
Rosalind Elsie Franklin fue una química y cristalógrafa
inglesa, responsable de importantes contribuciones a la comprensión de la
estructura del ADN (las imágenes por difracción de rayos X que revelaron la
forma de doble hélice de esta molécula son de su autoría), del ARN, de los
virus, del carbón y del grafito.
Determino:
- Las bases púricas y pirimidínicas se encuentran unas sobre otras, apiladas a lo largo del eje del polinucleótido a una distancia de 3,4Å.
- El diámetro del polinucleótido es de 20Åy está enrollado helicoidalmente alrededor de su eje. Cada 34Å se produce una vuelta completa de la hélice.
Basándose en estos dos tipos de datos Watson y Crick propusieron su Modelo de estructura para el ADN conocido con el nombre de Modelo de la Doble Hélice. Las características del Modelo delaDobleHélicesonlassiguientes.
- El ADN es una doble hélice enrollada helicoidalmente en sentidodextrorso,aladerecha.
- El ADN es una doble hélice enrollada helicoidalmente “a derechas” (sentido dextrorso). Algo parecido a dos muelles entrelazados.
- Grandes avances han ocurrido en los últimos años, hoy es posible determinar la secuencia de los residuos de nucleótidos en el ADN, se puede sintetizar polinucleótidos específicos.
Niveles estructurales de los Ácidos Nucleicos
 Estructura Primaria: Se trata de la secuencia de
desoxirribonucleótidos de una de las cadenas. La información genética está
contenida en el orden exacto de los nucleótidos. Las bases nitrogenadas que se
hallan formando los nucleótidos de ADN son Adenina, Guanina, Citosina y Timina.
Los nucleótidos se unen entre sí mediante el grupo fosfato del segundo
nucleótido, que sirve de puente de unión entre el carbono 5' del primer
nucleótido y el carbono 3' de siguiente nucleótido.
Estructura Primaria: Se trata de la secuencia de
desoxirribonucleótidos de una de las cadenas. La información genética está
contenida en el orden exacto de los nucleótidos. Las bases nitrogenadas que se
hallan formando los nucleótidos de ADN son Adenina, Guanina, Citosina y Timina.
Los nucleótidos se unen entre sí mediante el grupo fosfato del segundo
nucleótido, que sirve de puente de unión entre el carbono 5' del primer
nucleótido y el carbono 3' de siguiente nucleótido.
Como el primer nucleótido tiene libre el carbono 5' y el
siguiente nucleótido tiene libre el carbono 3', se dice que la secuencia de
nucleótidos se ordena desde 5' a 3' (5' → 3').
 Estructura Secundaria: Es una estructura en doble hélice.
Permite explicar el almacenamiento de la información genética y el mecanismo de
duplicación del ADN. Fue postulada por James Watson y Francis Crick.
Estructura Secundaria: Es una estructura en doble hélice.
Permite explicar el almacenamiento de la información genética y el mecanismo de
duplicación del ADN. Fue postulada por James Watson y Francis Crick.
Es una cadena doble, dextrógira o levógira, según el tipo
de ADN. Ambas cadenas son complementarias, pues la adenina de una se une a la
timina de la otra, y la guanina de una a la citosina de la otra. Estas bases
enfrentadas son las que constituyen los Puentes de Hidrógeno.
Adenina forma dos puentes de hidrógeno con Timina.
Guanina forma tres puentes de hidrógeno con Citosina. Ambas cadenas son
antiparalelas, pues el extremo 3´ de una se enfrenta al extremo 5´ de la otra.
Las dos hebras están enrolladas en torno a un eje imaginario, que gira en
contra del sentido de las agujas de un reloj. Las vueltas de estas hélices se
estabilizan mediante puentes de hidrógeno.
Esta estructura permite que las hebras que se formen por
duplicación de ADN sean copia complementaria de cada una de las hebras
existentes.
 Estructura Primaria: Se trata de la secuencia de
desoxirribonucleótidos de una de las cadenas. La información genética está
contenida en el orden exacto de los nucleótidos. Las bases nitrogenadas que se
hallan formando los nucleótidos de ADN son Adenina, Guanina, Citosina y Timina.
Los nucleótidos se unen entre sí mediante el grupo fosfato del segundo
nucleótido, que sirve de puente de unión entre el carbono 5' del primer
nucleótido y el carbono 3' de siguiente nucleótido.
Estructura Primaria: Se trata de la secuencia de
desoxirribonucleótidos de una de las cadenas. La información genética está
contenida en el orden exacto de los nucleótidos. Las bases nitrogenadas que se
hallan formando los nucleótidos de ADN son Adenina, Guanina, Citosina y Timina.
Los nucleótidos se unen entre sí mediante el grupo fosfato del segundo
nucleótido, que sirve de puente de unión entre el carbono 5' del primer
nucleótido y el carbono 3' de siguiente nucleótido.  Estructura Secundaria: Es una estructura en doble hélice.
Permite explicar el almacenamiento de la información genética y el mecanismo de
duplicación del ADN. Fue postulada por James Watson y Francis Crick.
Estructura Secundaria: Es una estructura en doble hélice.
Permite explicar el almacenamiento de la información genética y el mecanismo de
duplicación del ADN. Fue postulada por James Watson y Francis Crick.
Estructura terciaria:
El ADN presenta una estructura terciaria, que consiste en que la fibra de 20 Å
se halla retorcida sobre sí misma, formando una especie de super-hélice. Esta
disposición se denomina ADN Superenrollado, y se debe a la acción de
enzimas denominadas Topoisomerasas-II. Este enrollamiento da estabilidad a
la molécula y reduce su longitud.
Varía según se trate de organismos procariontes o eucariontes:
a) En procariontes se pliega como una super-hélice en forma,
generalmente, circular y asociada a una pequeña cantidad de proteínas.
Lo mismo ocurre en la mitocondrias y en los plastos.
b) En eucariontes el empaquetamiento ha de ser más
complejo y compacto y para esto necesita la presencia de proteínas, como son
las histonas y otras de naturaleza no histona (en los espermatozoides las
proteínas son las protamínas). A esta unión de ADN y proteínas se conoce como
Cromatina, en la cual se distinguen diferentes niveles de organización:
- Collar de perlas
- Fibra cromatínica
- Bucles radiales
-
Cromosoma.
El ADN es una molécula muy larga en algunas especies y, sin embargo,
en las células eucariotas se encuentra alojado dentro del minúsculo núcleo.
Cuando el ADN se une a proteínas básicas, la estructura se compacta mucho. Las
proteínas básicas son Histonas o Protamínas.
La unión con Histonas genera la
estructura denominada Nucleosoma. Cada nucleosoma está compuesto por una
estructura voluminosa, denominada Core, seguida por un eslabón o
"Linker". El core está compuesto por un octámero de proteínas,
Histonas, denominadas H2A, H2B, H3 y H4. Cada tipo de histona se presenta en
número par. Esta estructura está rodeada por un tramo de ADN que da una vuelta
y 3/4 en torno al octámero. El Linker está formado por un tramo de ADN que une
un nucleosoma con otro y una histona H1.
El conjunto de la estructura se
denomina Fibra de Cromatina de 100Å. Tiene un aspecto repetitivo en forma de
collar de perlas, donde las perlas serían los nucleosomas, unidos por los
linker.
Estructura cuaternaria:
La cromatina en el núcleo tiene un grosor de 300Å. La fibra de cromatina de
100Å se empaqueta formando una fibra de cromatina de 300Å. El enrollamiento
que sufre el conjunto de nucleosomas recibe el nombre de Solenoide.
Los solenoides se enrollan formando la
cromatina del núcleo interfásico de la célula
eucariota. Cuando la célula entra en división, el
ADN se compacta más, formando los
cromosomas.
Los nucleótidos son los bloques de construcción de los ácidos nucleicos
Los ácidos nucleicos son polinucleótidos, o polímeros de nucleótidos. Los nucleótidos tienen tres componentes: un azúcar con cinco carbonos, uno o más grupos fosfato y un compuesto nitrogenado débilmente básico llamado base. Las bases que se encuentran en los nucleótidos son pirimidinas y purinas sustituidas. La pentosa suele ser ribosa (D-ribofuranosa) o 2-desoxirribosa (2-desoxi-D-ribofuranosa). Los N-glicósidos pirimidina o purina de estos azúcares se llaman nucleósidos. Los nucleótidos son los ésteres de fosfato de los nucleósidos; los nucleótidos comunes contienen uno a tres grupos fosforilo. Los nucleótidos que contienen ribosa se llaman ribonucleótidos, y los que contienen desoxirribosa se llaman desoxirribonucleótidos.
A. Ribosa y desoxirribosa
Los dos azúcares aparecen como proyecciones de Haworth de la configuración b de las formas de anillo de furanosa. Es la configuración estable que existe en los nucleótidos y polinucleótidos. Cada uno de esos anillos de furanosa puede adoptar conformaciones diferentes. La conformación de la desoxirribosa predomina en el ADN de doble hebra.
B. Purinas y pirimidinas
Las estructuras de esos compuestos heterocíclicos, y los sistemas de numeración de los átomos de carbono y nitrógeno de cada base se muestran en la figura 19.3. La pirimidina tiene un solo anillo de cuatro átomos de carbono y dos de nitrógeno. La purina tiene un sistema de anillos fundidos de pirimidina y de imidazol. Los dos tipos de bases son no saturados, con dobles enlaces conjugados. Esta propiedad hace que los anillos sean planos, y también explica su capacidad de absorber la luz ultravioleta.
 Las purinas y pirimidinas sustituidas son ubicuas en las células vivas, pero casi nunca se encuentran las bases no sustituidas en los sistemas biológicos. Las principales pirimidinas que hay en los nucleótidos son uracilo (2,4-dioxopirimidina, U), timina (2,4-dioxo-5-metilpirimidina, T) y citosina (2-oxo-4-aminopirimidina, C). Las principales purinas son adenina (6-aminopurina, A) y guanina (2-amino-6-oxopurina, G).Nótese que como la timina es una forma sustituida de uracilo, también se puede llamar 5-metiluracilo. La adenina, la guanina y la citosina están en ribonucleótidos y desoxirribonucleótidos. El uracilo se encuentra principalmente en ribonucleótidos y la timina en desoxirribonucleótidos. Las purinas y las pirimidinas son bases débiles relativamente insolubles en agua al pH fisiológico. Sin embargo, dentro de las células la mayor parte de bases pirimidina y purina se encuentran como constituyentes de nucleótidos y polinucleótidos, compuestos que son muy hidrosolubles.
Las purinas y pirimidinas sustituidas son ubicuas en las células vivas, pero casi nunca se encuentran las bases no sustituidas en los sistemas biológicos. Las principales pirimidinas que hay en los nucleótidos son uracilo (2,4-dioxopirimidina, U), timina (2,4-dioxo-5-metilpirimidina, T) y citosina (2-oxo-4-aminopirimidina, C). Las principales purinas son adenina (6-aminopurina, A) y guanina (2-amino-6-oxopurina, G).Nótese que como la timina es una forma sustituida de uracilo, también se puede llamar 5-metiluracilo. La adenina, la guanina y la citosina están en ribonucleótidos y desoxirribonucleótidos. El uracilo se encuentra principalmente en ribonucleótidos y la timina en desoxirribonucleótidos. Las purinas y las pirimidinas son bases débiles relativamente insolubles en agua al pH fisiológico. Sin embargo, dentro de las células la mayor parte de bases pirimidina y purina se encuentran como constituyentes de nucleótidos y polinucleótidos, compuestos que son muy hidrosolubles.
C. Nucleósidos
Los nucleósidos están formados por ribosa y desoxirribosa y una base heterocíclica. En cada nucleósido, un enlace b-N-glicosídico conecta el C-1 del azúcar al N-1 de la pirimidina o al N-9 de la purina. Por consiguiente, los nucleósidos son derivados N-ribosilo o N-desoxirribosilo de las pirimidinas o las purinas. La convención de numeración para los átomos de carbono y nitrógeno de los nucleósidos refleja que están formados por una base y un azúcar de cinco carbonos, y cada uno de ellos tiene su propio esquema de numeración.
Los nombres de los nucleósidos se derivan de los de sus bases. El ribonucleósido que contiene adenina se llama adenosina (casi nunca se usa su nombre sistemático, 9-b-D-ribofuranosiladenina); su contraparte desoxi se llama desoxiadenosina. De igual modo, los ribonucleósidos de guanina, citosina y uracilo son guanosina, citidina y uridina, respectivamente.
D. Nucleótidos
Son derivadosfosforiladosde losnucleósidos.
- Los ribonucleósidos contienen tres grupos hidroxilos quesepuedenfosforilar(2’,3’ y 5’).
- Los desoxirribonucleósidos contienen dos de estos gruposhidroxilos(3’y5’).
- En los nucleósidos naturales, los grupos fosforilo suelen estar unidos al átomo de oxigeno del grupo 5’hidroxilo
REGLAS DE CHARGAFF PARA ADN DE DOBLE HÉLICE
- La proporción de Adenina (A) es igual a la de Timina (T). A= T . La relación entre Adenina y Timina es igual a la unidad (A/T= 1).
- La proporción de Guanina (G) es igual a la de Citosina (C). G= C. La relación entre Guanina y Citosina es igual a la unidad ( G/C=1).
- La proporción de bases púricas (A+G) es igual a la de las bases pirimidínicas (T+C). (A+G) = (T + C). La relación entre (A+G) y (T+C) es igual a la unidad (A+G)/(T+C)=1.
- Sin embargo, la proporción entre (A+T) y (G+C) era característica de cada organismo, pudiendo tomar por tanto, diferentes valores según la . Este resultado indicaba que los ácidos nucleicos no eran la repetición monótona de un tetranucleótido. Existía variabilidad en la composición de bases nitrogenadas.
Transcripción y procesamiento del ARN
El dogma central de la
biología molecular es:
ADN ———> ARN ——–>
PROTEINAS replicación –> transcripción –> traducción
Es un flujo unidireccional
de información aunque en algunos virus se sintetiza ADN a partir de ARN con la
retrotranscripción o transcripción inversa.
El ARN mensajero (ARNm)
A partir de una cadena de
ADN molde se forma una cadena de ARN monocatenario llamado ARNm o mensajero.
El ARNm es un completo
reflejo de las bases del DNA, es muy heterogéneo con respecto al tamaño, ya que
las proteínas varían mucho en sus pesos moleculares. Es capaz de asociarse con
ribosomas para la síntesis de proteínas y poseen una alta velocidad de recambio
debido a que se degradaría rápidamente también contienen U en lugar de T.
Los productos de la
transcripción no son sólo ARNm sino que también se forma ARNt y ARNr. Dentro
del ADN hay genes que codifican para ARNt y ARNr. La replicación y la transcripción
difieren en un aspecto muy importante, durante la replicación se copia el
cromosoma de ADN completo, pero la transcripción es selectiva, se puede regular
as¡ la transcripción del ADN. Secuencias reguladoras específicas indican el
principio y el fin de los segmentos de ADN que se tienen que transcribir, as¡
como que cadena se utilizar de molde. La cadena que sirve como molde al ARN es
la 3′-5′ y se llama con sentido y la otra es la antisentido cuya secuencia
coincide con la del ARNm transcrito.
El ARN mensajero puede ser
editado por mecanismos biológicos como se explica en este artículo.
El ARN transferente o de
transferencia (ARNt)
Los ARNt son relativamente
pequeños y monocatenarios. Como mínimo, ocho de los residuos de nucleótidos de
todos los tRNA tienen bases modificadas infrecuentes pero que son derivados
metilados de las principales. Tienen un residuo de G en el extremo 5′, y una
secuencia 5’CCA3′ en el extremo 3′. Forman una estructura en forma de hoja de
trébol con cuatro brazos mientras que su estructura tridimensional tiene el
aspecto de una L retorcida. En el ARNt est n los anticodones que son tres bases
complementarias del ARNm que codifican las proteínas.
Brazos
Brazo AAI o del aminoácido:
porta un aminoácido específico esterificado por su grupo carboxilo al grupo
hidroxilo 2′ o 3′ del residuo de A en el extremo 3′. Brazo del anticodón:
contiene el anticodón: Py-U-ANTICODÓN-Pu-Base (que no se aparea según el modelo
Watson y Crick).
Brazo DHU: contiene el
nucleótido dihidrouridina.
Brazo TYCG: contiene
ribotimina y pseudouridina.
Aminoacil-tRNA-sintetasas
Las aminoacil-tRNA
sintetasas tienen dos sustratos: el tRNA y el aminoácido. La reacción que
catalizan es cargar el tRNA con un aminoácido cosa que realizan en dos pasos y
mediante la hidrólisis de ATP. Se tiene que formar un enlace éster entre el
grupo carboxilo del aminoácido con el 3’OH del tRNA. Esta reacción se hace en
dos pasos: Primero se activa el aminoácido mediante su reacción con el ATP:
aa + ATP <———>
aminoacil-AMP + PPi
Segundo este compuesto reacciona
con el tRNA para dar:
aa-AMP <———>
aminoacil-tRNA + AMP
Hay dos tipos de
aminoacil-tRNA sintetasas que colocan el aminoácido en una u otra posición: en
2′ teniendo que sufrir despusé un proceso de transesterificación y en 3’OH
directamente. Son muy específicas. Las tRNA sintetasas pueden reconocer sólo el
anticodón, parcialmente el anticodón y elementos estructurales o no reconocen
el anticodón.
El ARN ribosómico (ARNr)
El ARN ribosómico forma
parte de los ribosomas y los hay de diferentes coeficientes de sedimentación.
En procariotas el ribosoma es de 70 S, siendo su subunidad pequeña de 30 S y la
grande de 50 S. La subunidad pequeña está formada por ARNr 16 S, y la grande
por ARNr 5 S y 23 S. En eucariotas el ribosoma es de 80 S, siendo su subunidad
pequeña de 40 S y la grande de 60 S. La subunidad pequeña está formada por ARNr
18 S, y la grande por ARNr 5 S, 5.8 S y 28 S. Los genes del ARNr actúan como
organizadores nucleolares.
ARN polimerasa
Es una RNA polimerasa
dirigida por ADN. Es una enzima que forma el enlace fosfodiéster en el RNA en
crecimiento mediante un ataque nucleofílico al nucleótido entrante. No necesita
cebador y sintetiza en dirección 5′-3′.
En los fagos tiene un peso
de 11 KDa. En procariotas es una única RNA pol (polimerasa) la que transcribe
todos los ARNs. Tiene cuatro subunidades proteicas: dos alfas, beta, beta prima
y sigma. Las dos alfa, beta y beta prima forman el núcleo de la enzima que es
la estructura que lleva a cabo el proceso de polimerización (es el centro
catalítico).
El factor sigma reconoce el
sitio de iniciación de la transcripción y por ello puede haber diferentes
sigmas. Reconoce secuencias específicas llamadas centros promotores. Una vez
que la RNA pol lleva iniciados dos o tres NTP se suelta sigma y sigue el
núcleo, este factor sigma se une a otro núcleo y continúa la transcripción
hasta que encuentra la señal de terminación que son diferentes. Su masa total
son 480 kDa.
En eucariotas hay tres tipos
de ARN polimerasas: I, II y III. Son mayores de 600 kDa y se dividen en dos
partes L y L’. Hay una ARN pol para cada tipo de ARN. ARN pol I (nucleolo) se
encarga de rRNA 18 S, 5.8 S y 28 S. La RNA pol II (nucleoplasma) se encarga de
precursores de mRNA y snRNA. La RNA pol III (nucleoplasma) se encarga del tRNA
y rRNA 5 S.
La a-amanitina (procede del
hongo Amanita phalloides) es un poderoso veneno que inhibe fuertemente a la RNA
pol II, y a altas concentraciones inhibe a ARN pol III. Con respecto a ARN pol
I es insensible. Afecta en primer lugar al hígado y puede excretarse por la
orina. Si el tejido hepático afectado es lo suficientemente importante se
produce la muerte. La dosis a la cual esta toxina es letal es la cantidad que
se encuentra en el sombrero de este hongo madurno.
En procariotas la
transcripción y la traducción es simultánea, mientras que las eucariotas
requieren primero una maduración del ARNm y después se produce la traducción.
Fases de la transcripción
Se requiere una región
promotora y otra terminadora. El factor sigma es el factor de la transcripción
como figura más arriba. La RNA pol se une al molde en los centros promotores,
es decir, en secuencias específicas del ADN para la unión de ARN pol. Poseen
una serie de características y reciben el nombre de secuencias consenso. Los
promotores están alineados de acuerdo con sus homologías, o secuencias de bases
similares que aparecen justo delante de la primera base transcrita llamada
punto de iniciación. El factor sigma permite que la enzima reconozca y se una
específicamente a las regiones promotoras. En primer lugar la holoenzima busca
un promotor e inicialmente se une a ‚l de una manera laxa.
- Iniciación
Una vez que sigma se ha
unido al promotor, se une el resto de la enzima y se forma una estructura
llamada “complejo del promotor cerrado”. A continuación se desenrolla un tramo
de ADN con lo que queda al descubierto el sitio de iniciación. La RNA pol se
fija más fuertemente formando el “complejo del promotor abierto”. Cuando entra
el segundo nucleótido empieza a formarse el enlace fosfodiéster. Cuando la RNA
pol se ha elongado un número pequeño de nucleótidos sigma se separa del núcleo.
- Elongación
La RNA pol debe sintetizar
ARN. Se sintetiza siempre en dirección 5′-3′. Pero para sintetizarlo se debe
desenrollar el ADN una corta distancia llamada “burbuja de replicación”. La
elongación presenta dos problemas: el dúplex debe enrollarse por detrás y
desenrollarse por delante. Así la RNA sigue el sentido de desenrollado y el RNA
se enrolla alrededor del dúplex con lo que no se produce superenrollamiento.
Además las topoisomerasas
alivian las tensiones eliminando los superenrollamientos. Se da entonces una
región infraenrollada por detrás y otra sobreenrollada por delante. El ARN se
sintetiza por emparejamiento de bases con una de las cadenas de ADN en una
región desenrollada transitoriamente. A medida que la región de
desenrollamiento avanza, el ADN de doble cadena se reconstituye por detrás de
ella, desplazando al ARN en forma de una cadena polinucleotida simple. Así, hay
un momento en el que se forma un híbrido de ADN:ARN.
- Terminación
La polimerasa de RNA
reconoce también señales de terminación de la cadena. Se dan dos tipos de
terminación: directa o mediada por proteínas.
La terminación directa hace
referencia a determinadas secuencias palindrómicas que cuando el ARN se
transcribe se enrollan en forma de horquilla y pierde estabilidad con lo que la
cadena se disocia.Después de la horquilla viene una región de poli(U) que parece
actuar como señal para que se suelte la polimerasa de ARN y termine la
transcripción.
La terminación mediada por
proteínas necesita de la proteína rho que reconoce la señal de terminación. No
tienen la cadena de poli(U) cuando se produce este mecanismo. Rho es un
hexámero formado por seis subunidades idénticas que aprovecha la hidrólisis de
ATP para desencadenar la reacción de terminación. EN primer lugar rho se une a
un sitio específico del ARN llamado rut, tras unirse a él rho viaja en
dirección 5′-3′ hasta que encuentra a la ARN pol y desenrolla el segmento
bicatenario RNA-DNA formado, por lo que se libera el RNA y la RNA pol cesando
la transcripción.
Procesamiento del ARNm
En primer lugar se le añade
un casquete de 7′-metilguanosina también llamado CAP. Mediante una
guanidiltransferasa, se ataca al fosfato interno del 7′-metilGTP y se libera un
pirofosfato, el Gp que queda se une al mRNA y se pierde un P del mRNA
inicial.Así se añade la gorra de metilguanosina.
En segundo lugar se le añade
una cola de poli(A). La RNA-pol sintetiza mRNA más allá de la secuencia de
corte: AUAAA. Esta secuencia sirve de señal para la adición de residuos de
adenina al complejo mediante la poliadenilato polimerasa mediante la hidrólisis
de ATP y una endonucleasa que elimina entre 11 y 20 nucleótidos del extremo 3′
y después es cuando la poliadenilato adiciona 20-250 nucleótidos de A. En el
sitio de corte de la endonucleasa es donde comienza a añadir A.
En tercer lugar se produce
el corte y empalme de intrones y exones. Es necesario eliminar los intrones y
empalmar los exones en un proceso conocido como corte y empalme. No necesita
ATP. Por diferentes mecanismos se cortan los intrones y se separan (el ARN
todav¡a con los intrones se llama ARNhn), posteriormente se fusionan los exones
y nos da lugar a un ARNm maduro, con su gorra de metilguanosina, su cola de
poli(A) y sin intrones.
Usos de los Ácidos Nucleicos en la Farmacia
Medicamentos Anti-Virales
Aciclovir
 El primer fármaco que se presentó como agente antiviral
verdaderamente selectivo y con éxito fue el aciclovir; que fue utilizado
como tratamiento profiláctico del herpes genital y cutáneo, y también en el
tratamiento de las lesiones causadas por el Herpes zoster. Durante los
últimos veinte años, el desarrollo de fármacos antivirales continuó aumentado
rápidamente, impulsado por la epidemia del sida. Los medicamentos antivirales
son a menudo «análogos de nucleósidos» (falsos nucleósidos, los bloques de
construcción de los ácidos nucleicos) que los virus incorporan a sus genomas
durante la replicación. El ciclo de vida del virus entonces se detiene debido a
que las nuevas cadenas de ADN sintetizadas son defectuosas. Esto se debe a que
los análogos carecen de los grupos hidroxilos que junto a los átomos de fósforo
forman los enlaces de la fuerte «columna vertebral» de la molécula de ADN. A
esto se le denomina interrupción de la cadena de ADN. Ejemplos de análogos
de nucleósidos son el aciclovir para tratar el virus del herpes y lamivudina
para las infecciones de VIH y hepatitis B. Aciclovir es uno de los fármacos
antivirales más antiguos y frecuentemente prescritos.
El primer fármaco que se presentó como agente antiviral
verdaderamente selectivo y con éxito fue el aciclovir; que fue utilizado
como tratamiento profiláctico del herpes genital y cutáneo, y también en el
tratamiento de las lesiones causadas por el Herpes zoster. Durante los
últimos veinte años, el desarrollo de fármacos antivirales continuó aumentado
rápidamente, impulsado por la epidemia del sida. Los medicamentos antivirales
son a menudo «análogos de nucleósidos» (falsos nucleósidos, los bloques de
construcción de los ácidos nucleicos) que los virus incorporan a sus genomas
durante la replicación. El ciclo de vida del virus entonces se detiene debido a
que las nuevas cadenas de ADN sintetizadas son defectuosas. Esto se debe a que
los análogos carecen de los grupos hidroxilos que junto a los átomos de fósforo
forman los enlaces de la fuerte «columna vertebral» de la molécula de ADN. A
esto se le denomina interrupción de la cadena de ADN. Ejemplos de análogos
de nucleósidos son el aciclovir para tratar el virus del herpes y lamivudina
para las infecciones de VIH y hepatitis B. Aciclovir es uno de los fármacos
antivirales más antiguos y frecuentemente prescritos.Dosis: Aciclovir viene envasado como tabletas, cápsulas o suspensión (líquido) para tomar por vía oral. Por lo general se toma con o sin alimentos 2 a 5 veces al día durante 5 a 10 días, comenzando lo antes posible después de haber notado los primeros síntomas. Cuando el aciclovir se usa para prevenir los brotes del herpes genital, por lo general se toma 2 a 5 veces al día durante un año (12 meses). Tome el aciclovir alrededor del mismo horario todos los días. Siga cuidadosamente las instrucciones en la etiqueta del medicamento y pregúntele a su doctor o farmacéutico cualquier cosa que no entienda.
Composición: C8H11N5O3
El aciclovir es un análogo de la guanina. Su estructura difiere de otros análogos de nucleósidos en que contiene sólo una parte de éste ya que el anillo glucídico está reemplazado por una cadena abierta.
Se considera una prodroga, debido a que su forma original es inactiva, y sus metabolitos son las sustancias antivirales activas.
El aciclovir es un análogo de la guanina. Su estructura difiere de otros análogos de nucleósidos en que contiene sólo una parte de éste ya que el anillo glucídico está reemplazado por una cadena abierta.
Se considera una prodroga, debido a que su forma original es inactiva, y sus metabolitos son las sustancias antivirales activas.
Ribavirina:
La hepatitis C es causada por un virus ARN. En el 80 % de las personas infectadas, la enfermedad es crónica y sin tratamiento continúan siendo infecciosas para el resto de sus vidas. Sin embargo, ahora existe un tratamiento efectivo con el fármaco ribavirina, un análogo de nucleósido, en combinación con interferón. Actualmente se está desarrollando una estrategia similar con lamivudina para el tratamiento de los portadores crónicos de hepatitis B. Otros fármacos antivirales en uso tienen como objetivo diferentes etapas del ciclo replicativo viral. El VIH depende de una enzima proteolítica denominada proteasa VIH-1 para ser plenamente infeccioso. Existe una clase de medicamentos denominados inhibidores de la proteasa que han sido diseñados para inactivar esta enzima.
La dosis a administrar: de ribavirina se basa en el peso corporal del
paciente. Este medicamento se administrapor vía oral diariamente, dividido en
dos tomas (mañana y noche) con los alimentos.
Contraindicaciones:
- Mujeres
embarazadas. El tratamiento con ribavirina no deberá iniciarse hasta que se
haya obtenido un resultado negativo de un test de embarazo, practicado inmediatamente
antes del comienzo del tratamiento.
- Lactancia.
- Enfermedad cardiaca
grave preexistente, como cardiopatía inestable o no controlada, en los seis
meses anteriores.
- Pacientes con
situaciones clínicas graves.
- Pacientes con
insuficiencia renal crónica, pacientes con aclaramiento de creatinina < 50
ml/minuto y/o en hemodiálisis.
- Insuficiencia
hepática grave (clasificación B o C de Child-Pugh) o cirrosis hepática descompensada.
- Hemoglobinopatías
(p. ej., talasemia, anemia de células falciformes).
Zidovudina
Usos: El sida, provocado por el VIH, tiene un tratamiento antiviral de zidovudina (azidotimidina o AZT). La zidovudina es un potente inhibidor de la transcriptasa inversa (RT), enzima esencial en el proceso de replicación del VIH. Sin embargo, sus efectos no son duraderos y en algunos casos, éstos son inútiles, puesto que el VIH es un retrovirus y su genoma de AR0N debe ser transcrito por la RT para convertirlo en una molécula de ADN que constituye el provirus. La zidovudina no tiene ningún efecto sobre el provirus, ya que solo inhibe su formación más no la expresión de ésta en las células huéspedes. Por otra parte, el uso duradero de zidovudina podría provocar una mutación del VIH, haciendo resistente al virus a este tratamiento.
Dosis: La zidovudina (marca
comercial: Retrovir) viene en las siguientes dosis y formas:
Tabletas de 300 mg.
Cápsulas de 100 mg.
Jarabe de 10 mg/ml.
Envase de uso único
de 20 ml (cada uno de los cuales contiene 10 mg de zidovudina) de solución para
infusión intravenosa.
 Tome la zidovudina de
acuerdo con las instrucciones de su proveedor de atención de salud.Tome las
tabletas, las cápsulas y el jarabe de zidovudina solos o con alimentos. Antes
del uso, la solución de zidovudina para infusión intravenosa se diluye con dextrosa
(azúcar disuelta en agua). La solución diluida se aplica lentamente (durante 1
hora) en la vena con una aguja o un catéter
Tome la zidovudina de
acuerdo con las instrucciones de su proveedor de atención de salud.Tome las
tabletas, las cápsulas y el jarabe de zidovudina solos o con alimentos. Antes
del uso, la solución de zidovudina para infusión intravenosa se diluye con dextrosa
(azúcar disuelta en agua). La solución diluida se aplica lentamente (durante 1
hora) en la vena con una aguja o un catéter
Peso molecular:
267.2437
Contraindicaciones: La zidovudina puede
causar efectos secundarios graves, potencialmente mortales, entre ellos, acidosis
láctica (acumulación de ácido en la sangre), trastornos del hígado, debilidad
muscular (miopatía) y trastornos sanguíneos como anemia grave (reducción
extrema del número de glóbulos rojos) o neutropenia (reducción del número de
glóbulos blancos).
Doxorrubicina
 Condiciones o
enfermedades se prescribe este medicamento: La doxorrubicina se
usa en combinación con otros medicamentos para tratar determinados tipos de
cáncer de vejiga urinaria, de seno, de pulmón, de estómago y de ovario; linfoma
de Hodgkin (enfermedad de Hodgkin) y linfoma no Hodgkin (cáncer que comienza en
las células del sistema inmunitario); y determinados tipos de leucemia (cáncer
de los glóbulos blancos), incluidas leucemia linfoblástica aguda (ALL, por sus
siglas en inglés) y leucemia mieloide aguda (AML, por sus siglas en inglés; leucemia
no linfocítica aguda [ANLL, por sus siglas en inglés]). La doxorrubicina
también se usa sola y en combinación con otros medicamentos para tratar
determinados tipos de cáncer de tiroides y determinados tipos de sarcomas óseos
o de tejidos blandos (cáncer que se forma en los músculos y los huesos).
También se usa para tratar neuroblastomas (un cáncer que comienza en las
neuronas y que, principalmente, ocurre en niños) y tumores de Wilms (un tipo de
cáncer de riñón que ocurre en niños). La doxorrubicina pertenece a una clase de
medicamentos llamados antraciclinas. Actúa retardando o deteniendo el
crecimiento de las células cancerosas en el cuerpo.
Condiciones o
enfermedades se prescribe este medicamento: La doxorrubicina se
usa en combinación con otros medicamentos para tratar determinados tipos de
cáncer de vejiga urinaria, de seno, de pulmón, de estómago y de ovario; linfoma
de Hodgkin (enfermedad de Hodgkin) y linfoma no Hodgkin (cáncer que comienza en
las células del sistema inmunitario); y determinados tipos de leucemia (cáncer
de los glóbulos blancos), incluidas leucemia linfoblástica aguda (ALL, por sus
siglas en inglés) y leucemia mieloide aguda (AML, por sus siglas en inglés; leucemia
no linfocítica aguda [ANLL, por sus siglas en inglés]). La doxorrubicina
también se usa sola y en combinación con otros medicamentos para tratar
determinados tipos de cáncer de tiroides y determinados tipos de sarcomas óseos
o de tejidos blandos (cáncer que se forma en los músculos y los huesos).
También se usa para tratar neuroblastomas (un cáncer que comienza en las
neuronas y que, principalmente, ocurre en niños) y tumores de Wilms (un tipo de
cáncer de riñón que ocurre en niños). La doxorrubicina pertenece a una clase de
medicamentos llamados antraciclinas. Actúa retardando o deteniendo el
crecimiento de las células cancerosas en el cuerpo.
Cómo se debe usar
este medicamento: La presentación de la
doxorrubicina es una solución (líquido) o un polvo que se mezcla con líquido y
que un médico o un enfermero inyectan por vía intravenosa (en una vena) en un
centro médico. Por lo general, se administra una vez cada 21 a 28 días. La
duración del tratamiento depende del tipo de medicamentos que esté tomando, de
la manera en que su cuerpo responda a ellos y del tipo de cáncer que tenga.
Molécula de la Doxorrubicina:
Molécula de la Doxorrubicina:
- informe a su médico y a su farmacéutico si es alérgico a la doxorrubicina, la daunorrubicina (Cerubidine, DaunoXome), la epirrubicina (Ellence), la idarrubicina (Idamycin), a algún otro medicamento o a alguno de los ingredientes de la doxorrubicina inyectable. Pídale a su farmacéutico una lista de los ingredientes.
- informe a su médico y a su farmacéutico qué otros medicamentos con y sin receta, vitaminas, suplementos nutricionales y productos herbarios está tomando o planea tomar. No olvide mencionar los medicamentos que aparecen en la lista de la sección ADVERTENCIA IMPORTANTE y cualquiera de los siguientes: determinados medicamentos usados en la quimioterapia, como la citarabina (DepoCyt), el dexrazoxano (Zinecard), la mercaptopurina (Purinethol), la estreptozocina (Zanosar); el fenobarbital (Luminal Sodium) o la fenitoína (Dilantin). Es posible que su médico deba cambiar las dosis de sus medicamentos o vigilarlo de cerca por si presentara efectos secundarios. Es posible que otros medicamentos también interactúen con la doxorrubicina, por lo que no debe olvidar informar a su médico sobre todos los medicamentos que esté tomando, incluso los que no aparecen en esta lista.
Comentarios de los Videos
Vídeo 1: Replicación de ADN
La replicación es un
proceso importante para los seres vivos ya que permite que se pueda transmitir
la información de la célula madre a las células hijas. En la replicación del ADN de doble hélice se
da primero el rompimiento de los puentes de hidrogeno entre las dos cadenas
ayudado por la enzima helicasa y luego las proteínas SSBs ayudan a que estas
dos hebras no se unan de nuevo, formándose
así la burbuja de replicación. Este proceso ocurre en varias partes de la
cadena.
Luego viene la RNA
primasa e insertara los primeros nucleótidos de la nueva cadena. Ese segmento
resultante es llamado RNA cebador.
LA ADN polimerasa III
construirá una nueva cadena en dirección 5’ a 3’ a partir de ese segmento. Después
de esto el ADN Polimerasa I remplaza los nucleótidos del cebador y por último
el ADN ligasa une todos los segmentos resultantes de las burbujas de replicación,
de igual manera en la cadena rezagada. Formándose así dos nuevas cadenas de
doble hélice de ADN.
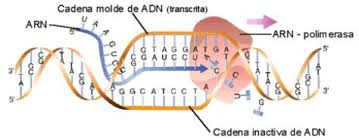
Video 2: Transcripción de ADN a ARN
El ADN en la
transcripción se codifica (envía mensajes en forma de códigos) a partir de una
de sus cadenas de nucleótidos dentro del Núcleo al ARN mensajero para que se
ejecute la orden en el Citoplasma por Traducción e iniciar la Síntesis de
Proteínas. Es decir el Proceso donde el ADN se copia a ARN siendo la primera
etapa de la expresión génica.
Unos de los factores
que actúa en este proceso es el ARN polimerasa donde desenrollará y leerá la
cadena del ADN e ira copiando una de las dos hebras y luego dentro de esta
enzima ira insertando los nucleótidos complementarios y sustituyendo la base de
timina por las del uracilo.
La importancia de la
transcripción del ADN en el caso de las plantas es fundamental, ya que al no
tener muchas de ellas por decirlo de alguna forma "sexo definido"
como los animales... Se debe garantizar una copia de la siguiente generación de
las mismas, y la preservación de sus características.
En el caso de los
animales los genes dominantes garantizan al igual que en las plantas
"generaciones" más fuertes de individuos ya que de ser lo contrario
las especies estarían destinadas a una extinción repentina.
Y en términos más
específicos las copias del mismo ADN permiten la transmisión adecuada de
proteínas dentro del organismo, alimentando a las células del cuerpo para que
así este tenga la energía necesaria para subsistir.
Video 3: Traducción de ADN a proteína
La traducción
corresponde al proceso de síntesis de proteínas que tiene lugar en los
ribosomas. La secuencia de nucleótidos que posee el ARNm es interpretada para
permitir el ordenamiento y unión de los aminoácidos necesarios para construir
un polipeptido o proteína.
Tipo de ARN:
a) ARNm: ARN que sirve de intermediario entre
el ADN y la síntesis de proteínas.
b) ARNt: ARN que es el verdadero diccionario
por medio de las cuales se traduce el lenguaje de los ácidos nucleicos. Hay más
de 20 tipos de ARNt en cada celula, uno para cada aminoácido.
c) ARNr: este ARN junto con un grupo de
proteínas, forma el ribosoma, lugar donde se sintetizan las proteínas. Los
ribosomas consisten 2 subunidades, una pequeña (presenta lugar para la unión del
ARN mensajero)y otra grande (Presenta dos sitios de unión para el ARNt: el
sitio P “peptidico” y al sitio A “aminoacilico”)
Proceso de la traducción
1.- Iniciación:
El triplete AUG es la
señal de inicio para la síntesis proteica. En respuesta a esto, se incorpora
como primer complejo de transferencia llamado formil-metionil-ARNt, que trae un
aminoácido especial: la formil metionina
2.- Elongación: En
esta fase se forma un enlace peptídico entre la cadena polipeptídica en formación
y el grupo amino del ARNt.
En los ribosomas
están los sitios A y P, determinados
para recibir aminoácidos. Al iniciarse la síntesis proteica, el sitio P
queda ocupado por el formil.metionil ARNt. El ARNt que trae el segundo
aminoácido se ubica el sitio A.
Cada nuevo aminoácido
llega a ocupar el sitio A, y en el sitio P se encuentra con la cadena peptídica llevando en su extremo el
aminoácido que se unirá al sitio A mediante enlace peptídico. Luego el ARNt que
ha cedido su aminoácido, abandona el sitio P, quedando libre para otro
aminoácido.
El ARNm avanza la
distancia de un codón o triplete a la vez. Los aminoácidos se van uniendo
mediante enlaces pépticos en unidades cada vez mayores
3.- Terminacion: Cuando
la proteína ha alcanzado su longitud final, el proceso se acaba mediante una
serie de factores de liberación que son capaces de reconocer los codones de terminación
(UAA, UAG, UGA).





































No hay comentarios:
Publicar un comentario