Enzimas
A las formas tridimensionales de las proteínas les permiten desempeñar papeles estructurales y de transporte. Ahora se describirán sus funciones como enzimas. Las enzimas son catalizadores biológicos selectivos de una eficiencia extraordinaria. Toda célula viva dispone de cientos de enzimas distintas que catalizan las reacciones esenciales para la vida. Estas enzimas catalizan las reacciones de las rutas metabólicas centrales, necesarias para mantener la vida.
Propiedades de las enzimas
El papel principal de las enzimas es aumentar las velocidades de tales reacciones. En forma típica, las reacciones catalizadas por las enzimas son de 103 a 1020 veces más rápidas que las mismas sin catalizar.
 Un catalizador es una sustancia que acelera la llegada a un equilibrio. Un catalizador puede cambiar en forma temporal durante la reacción, pero no cambia en el proceso general, porque se recicla para participar en varias reacciones. Los reactivos se unen a un catalizador y los productos se disocian de él. Un catalizador no cambia la posición del equilibrio de la reacción (es decir, no hace que una reacción no favorable sea favorable). Más bien reduce la cantidad de energía necesaria para que se efectúe la reacción.
Un catalizador es una sustancia que acelera la llegada a un equilibrio. Un catalizador puede cambiar en forma temporal durante la reacción, pero no cambia en el proceso general, porque se recicla para participar en varias reacciones. Los reactivos se unen a un catalizador y los productos se disocian de él. Un catalizador no cambia la posición del equilibrio de la reacción (es decir, no hace que una reacción no favorable sea favorable). Más bien reduce la cantidad de energía necesaria para que se efectúe la reacción.
Muchas enzimas poseen estereoespecificidad ya que sólo actúan sobre un estereoisómero del sustrato. Quizá el aspecto más importante de la especificidad de una enzima es la especificidad de reacción, esto es, la falta de formación de subproductos como desperdicios. La especificidad de reacción se refleja en la pureza excepcional del producto (100% en esencia) —mucho mayor que la pureza de productos de reacciones típicas catalizadas en química orgánica. La especificidad de las enzimas no sólo ahorra energía a las células sino que también evita la formación de productos metabólicos potencialmente tóxicos.
Además pueden combinar, o acoplar, dos reacciones que normalmente serían separadas. Esta propiedad permite que la energía ganada en una reacción se use en una segunda reacción. Las reacciones acopladas son una propiedad común de muchas enzimas; por ejemplo, la hidrólisis del ATP se acopla con frecuencia a reacciones metabólicas menos favorables.
Clase de Enzimas
1. Las oxidorreductasas catalizan las reacciones de oxidación-reducción. La mayor parte de esas enzimas se llaman, en general, deshidrogenasas. También hay otras enzimas en esta clase que se llaman oxidasas, peroxidasas, oxigenasas o reductasas.
Ejemplo:
2. Las transferasas catalizan las reacciones de transferencia de un grupo y pueden necesitar la presencia de coenzimas. En las reacciones de transferencia de grupo, una parte de la molécula del sustrato se suele enlazar en forma covalente con la enzima o con su coenzima. Este grupo incluye las cinasas, enzimas que catalizan la transferencia de un grupo fosforilo del ATP.
Ejemplo:
3. Las hidrolasas catalizan hidrólisis. Son una clase especial de transferasas donde el agua sirve como aceptor del grupo transferido.
Ejemplo:
4. Las liasas catalizan la lisis de un sustrato, al generar un enlace doble; son reacciones de eliminación, no hidrolíticas y no oxidantes. En dirección inversa, las liasas catalizan la adición de un sustrato a un doble enlace de un segundo sustrato. Una liasa que cataliza una reacción de adición en las células es frecuentemente llamada sintasa.
Ejemplo:

5. Las Isomerasas catalizan cambios estructurales dentro de una misma molécula (reacciones de isomerización). Como estas reacciones sólo tienen un sustrato y un producto son de las reacciones enzimáticas más simples.
Ejemplo:
6. Las ligasas catalizan la ligadura o unión de dos sustratos. Estas reacciones necesitan un suministro de energía potencial química de un nucleósido trifosfato, como el ATP. Las ligasas son usualmente llamadas sintetasas.
Ejemplo:
Video:
- Experimentos cinéticos revelan propiedades de las enzimas
A. Cinética química
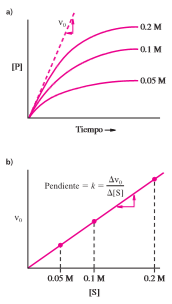 En los experimentos cinéticos se examina la relación entre la cantidad de producto (P) que se forma en una unidad de tiempo ( [P]/ t) y las condiciones experimentales bajo las que se efectúa la reacción. La base de la mayor parte de las mediciones cinéticas es la observación de la rapidez, o velocidad (v), de una reacción, la cual varía en forma directa con la concentración de cada reactante.
En los experimentos cinéticos se examina la relación entre la cantidad de producto (P) que se forma en una unidad de tiempo ( [P]/ t) y las condiciones experimentales bajo las que se efectúa la reacción. La base de la mayor parte de las mediciones cinéticas es la observación de la rapidez, o velocidad (v), de una reacción, la cual varía en forma directa con la concentración de cada reactante.
Δ[P]/ Δt= v = k [S]
La ecuación de velocidad refleja que la velocidad de una reacción depende de la concentración del sustrato ([S]). El símbolo k es la constante de velocidad e indica la velocidad o la eficiencia de una reacción. Cada reacción tiene una constante de velocidad diferente. Las unidades de la constante de velocidad para una reacción simple son s- 1. Al avanzar una reacción, la cantidad de producto ([P]) aumenta y la cantidad de sustrato ([S]) disminuye.
Velocidad de una reacción química simple. a) Se grafica la cantidad de producto elaborado durante cierto tiempo para diversas concentraciones iniciales de sustrato. La velocidad inicial, v0, es la pendiente del progreso de la curva al iniciar la reacción. b) La velocidad inicial en función de la concentración inicial del sustrato. La pendiente de la curva es la constante de velocidad.
B. Cinética enzimática
Emil Fischer, en 1894, propuso que una enzima presenta una plantilla rígida, o cerradura, y que el sustrato es la llave que le corresponde. Sólo los sustratos específicos se pueden ajustar a determinada enzima. Los primeros estudios de cinética enzimática confirmaron que una enzima (E) se une a un sustrato para formar un complejo enzima-sustrato (ES). Los complejos ES se forman cuando los ligandos se unen de manera no covalente a sus lugares adecuados en el sitio activo. El sustrato reacciona en forma transitoria con la proteína catalizadora (y con otros sustratos, en una reacción multisustratos) para formar el producto de la reacción.
Imagínese ahora una reacción enzimática simple, la conversión de un sustrato en un producto catalizada por una enzima. Aunque la mayor parte de las reacciones enzimáticas tiene dos o más sustratos, se pueden describir los principios generales de la cinética enzimática suponiendo el caso sencillo en que hay un sustrato y un producto.
E +S → ES→E+P
Imagínese ahora una reacción enzimática simple, la conversión de un sustrato en un producto catalizada por una enzima. Aunque la mayor parte de las reacciones enzimáticas tiene dos o más sustratos, se pueden describir los principios generales de la cinética enzimática suponiendo el caso sencillo en que hay un sustrato y un producto.
E +S → ES→E+P
Esta reacción se efectúa en dos pasos distintos: la formación del complejo enzima-sustrato y la reacción química actual, acompañada por la disociación del producto. Cada paso transcurre con una velocidad característica. La velocidad total de una reacción enzimática depende de las concentraciones tanto del sustrato como del catalizador (la enzima). Cuando la cantidad de enzima es mucho menor que la cantidad de sustrato, la reacción depende de la cantidad de enzima.

- Ecuación de Michaelis-Menten
Las primeras ecuaciones de velocidad fueron deducidas a principios de 1900 examinando los efectos de variaciones en la concentración de sustrato.
La ecuación de Michaelis-Menten describe la relación entre la velocidad inicial de una reacción y la concentración del sustrato.
A. Deducción de la Ecuación de Michaelis- Menten
![\frac{d[ES]}{dt} = k_1[E][S] - k_{-1}[ES] - k_2[ES] = 0](https://upload.wikimedia.org/math/2/e/6/2e6707bd7249367db2783d7528b0f27e.png)
![[ES] = \frac{k_1[E][S]}{k_{-1} + k_2}](https://upload.wikimedia.org/math/2/3/9/2393da149da6383e1007c38704cc3f43.png)
Se define:

Entonces:
![[ES] = \frac{[E][S]}{K_m}](https://upload.wikimedia.org/math/0/6/7/067e112a39ebb7ff143866a36bad4b6f.png) (1)
(1)La velocidad de reacción es:
![\frac{d[P]}{dt} = k_2[ES]](https://upload.wikimedia.org/math/7/a/3/7a3243fe528e37d5f80483285ecef361.png) (2)
(2)
La concentración total de la enzima:
![[E_0] = [E] + [ES]](https://upload.wikimedia.org/math/d/7/d/d7df5aef328f368d84d2d0ea9d13a4cf.png)
Por lo tanto:
![[E] = [E_0] - [ES]](https://upload.wikimedia.org/math/3/e/a/3eadb144c8cbf50e0b38e1f7ab9974a9.png) (3)
(3)Sustituyendo (3) en (1) da:
![[ES] = \frac{([E_0] - [ES]) [S]}{K_m}](https://upload.wikimedia.org/math/6/1/0/6106c8382e6fcce1a66cf6844de78b21.png)
Reordenando:
![K_m[ES]+[S][ES]=[E_0][S]](https://upload.wikimedia.org/math/6/d/e/6dea0cf86320ea5ce1521e094a19293a.png)
![[ES]=\frac{[E_0][S]}{K_m+[S]}](https://upload.wikimedia.org/math/a/e/d/aed38f76ff52b2f778296c31f6a8ef09.png) (4)
(4)
Sustituyendo (4) en (2) :
![\frac{d[P]}{dt} = k_2[E_0]\frac{[S]}{K_m + [S]} = V_{max}\frac{[S]}{K_m + [S]}](https://upload.wikimedia.org/math/6/f/b/6fb713b192f50c8136572a36dcb3d905.png)
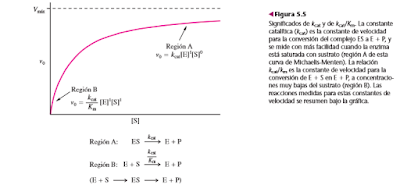
Cuando la concentración de sustrato es alta, la velocidad total de la reacción es Vmáx y está determinada por la concentración de la enzima. La constante de velocidad observada bajo estas condiciones se llama constante catalítica, Kcat, y se define como sigue:
donde kcat representa la cantidad de moles de sustrato convertidos en producto, por segundo y por mol de enzima (o por mol de sitio activo, para una enzima con multisubunidades) bajo condiciones de saturación. En otras palabras, kcat indica la cantidad máxima de moléculas de sustrato convertidas en producto cada segundo por cada sitio activo. A eso se le llama con frecuencia número de recambio. La constante catalítica mide la rapidez con que determinada enzima puede catalizar una reacción específica; es una forma muy útil para describir la eficacia de una enzima.
C. Significados de Km
la constante Km se define como la relación de las constantes de velocidad combinadas para la descomposición de ES dividida entre la constante para su formación. Si la constante de velocidad para la formación de producto (k2) es mucho menor que k1 o que k 1, como es el caso frecuente, se puede despreciar k2 y Km equivale a k 1/k1. En este caso, Km es igual a la constante de equilibrio de disociación de ES para dar E + S. Así, Km es una medida de la afinidad de E hacia S. Mientras menor sea el valor de Km, el sustrato está más fuertemente unido. Km también es uno de los parámetros que determina la forma de la curva de Vo en función de [S]. Es la concentración del sustrato cuando la velocidad inicial es la mitad del valor de Vmáx. Este significado es consecuencia directa de la ecuación general de una hipérbola rectangular.
Video:
Las constantes cinéticas indican la actividad enzimática y la eficiencia catalítica
Está demostrado que las constantes cinéticas km y kcat se pueden usar para medir las actividades relativas de las enzimas y los sustratos. En la mayor parte de los casos, Km es una medida de la estabilidad del complejo ES, y kcat es similar a la constante de velocidad para la conversión de ES en E+ P, y cuando el sustrato no es limitante.
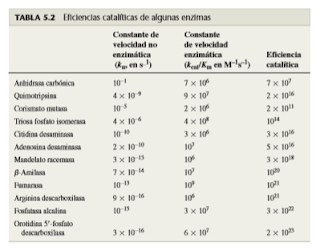 La relación kcat/Km es útil para comparar las actividades de enzimas diferentes. También es posible evaluar la eficiencia de una enzima midiendo su capacidad catalítica. Este valor es igual a la constante de velocidad de una reacción en presencia de la enzima (kcat/Km) dividida entre la constante de velocidad de la misma reacción en ausencia de la enzima (kn). Es de sorprender que sólo se conozcan pocos valores de eficiencia catalítica porque la mayor parte de las reacciones químicas se efectúa con lentitud extrema en ausencia de las enzimas —con tanta lentitud que sus velocidades sin enzima son muy difíciles de medir. Con frecuencia, las velocidades de reacción se miden en recipientes especiales de vidrio encerrados en acero a temperaturas mayores de 300°C.
La relación kcat/Km es útil para comparar las actividades de enzimas diferentes. También es posible evaluar la eficiencia de una enzima midiendo su capacidad catalítica. Este valor es igual a la constante de velocidad de una reacción en presencia de la enzima (kcat/Km) dividida entre la constante de velocidad de la misma reacción en ausencia de la enzima (kn). Es de sorprender que sólo se conozcan pocos valores de eficiencia catalítica porque la mayor parte de las reacciones químicas se efectúa con lentitud extrema en ausencia de las enzimas —con tanta lentitud que sus velocidades sin enzima son muy difíciles de medir. Con frecuencia, las velocidades de reacción se miden en recipientes especiales de vidrio encerrados en acero a temperaturas mayores de 300°C.
 Los parámetros cinéticos de una reacción enzimática pueden producir información valiosa acerca de la especificidad y el mecanismo de la reacción. Los parámetros clave son Km y Vmáx ya que kcat se puede calcular si se conoce Vmáx.
Los parámetros cinéticos de una reacción enzimática pueden producir información valiosa acerca de la especificidad y el mecanismo de la reacción. Los parámetros clave son Km y Vmáx ya que kcat se puede calcular si se conoce Vmáx.
 Las reacciones de multisustrato pueden efectuarse de acuerdo con varios y distintos esquemas cinéticos llamados mecanismos cinéticos porque se deducen en su totalidad mediante experimentos cinéticos. Como se muestra en la figura 5.7, la secuencia de pasos va de izquierda a derecha. La adición de moléculas de sustrato (A, B, C, …) a la enzima y la liberación de productos (P, Q, R, …) desde la enzima se indican con flechas que apuntan hacia (unión de sustrato) o desde (liberación de producto) de la recta. Las diversas formas de la enzima (E libre, complejos ES o complejos EP) se escriben abajo de una línea horizontal. Los complejos ES que sufren transformación química cuando el sitio activo está lleno se muestran entre paréntesis. Las reacciones consecutivas (o secuenciales) (figura 5.7a) requieren que todos los sustratos estén presentes para que se libere algún producto. Estas reacciones secuenciales pueden ser ordenadas, con un orden obligatorio de enlazamiento de sustratos y de liberación de productos. También pueden ser aleatorias, sin orden obligatorio de enlazamiento o liberación. En las reacciones ping-pong (figura 5.7b), se libera un producto antes de que se enlacen todos los sustratos. En una reacción ping-pong de bisustrato, se enlaza el primer sustrato, se altera la enzima por sustitución y se libera el primer producto, después de lo cual se une el segundo sustrato, la enzima alterada regresa a su forma original y se libera el segundo producto. Debido al enlazamiento covalente de una porción de un sustrato a la enzima, a veces al mecanismo de ping-pong se le llama mecanismo de enzima sustituida. La unión y liberación de ligandos en un mecanismo de ping-pong se suelen indicar con líneas inclinadas. Las dos formas de la enzima se representan por E (no sustituida) y F (sustituida).
Las reacciones de multisustrato pueden efectuarse de acuerdo con varios y distintos esquemas cinéticos llamados mecanismos cinéticos porque se deducen en su totalidad mediante experimentos cinéticos. Como se muestra en la figura 5.7, la secuencia de pasos va de izquierda a derecha. La adición de moléculas de sustrato (A, B, C, …) a la enzima y la liberación de productos (P, Q, R, …) desde la enzima se indican con flechas que apuntan hacia (unión de sustrato) o desde (liberación de producto) de la recta. Las diversas formas de la enzima (E libre, complejos ES o complejos EP) se escriben abajo de una línea horizontal. Los complejos ES que sufren transformación química cuando el sitio activo está lleno se muestran entre paréntesis. Las reacciones consecutivas (o secuenciales) (figura 5.7a) requieren que todos los sustratos estén presentes para que se libere algún producto. Estas reacciones secuenciales pueden ser ordenadas, con un orden obligatorio de enlazamiento de sustratos y de liberación de productos. También pueden ser aleatorias, sin orden obligatorio de enlazamiento o liberación. En las reacciones ping-pong (figura 5.7b), se libera un producto antes de que se enlacen todos los sustratos. En una reacción ping-pong de bisustrato, se enlaza el primer sustrato, se altera la enzima por sustitución y se libera el primer producto, después de lo cual se une el segundo sustrato, la enzima alterada regresa a su forma original y se libera el segundo producto. Debido al enlazamiento covalente de una porción de un sustrato a la enzima, a veces al mecanismo de ping-pong se le llama mecanismo de enzima sustituida. La unión y liberación de ligandos en un mecanismo de ping-pong se suelen indicar con líneas inclinadas. Las dos formas de la enzima se representan por E (no sustituida) y F (sustituida).
Video:
Las constantes cinéticas indican la actividad enzimática y la eficiencia catalítica
Está demostrado que las constantes cinéticas km y kcat se pueden usar para medir las actividades relativas de las enzimas y los sustratos. En la mayor parte de los casos, Km es una medida de la estabilidad del complejo ES, y kcat es similar a la constante de velocidad para la conversión de ES en E+ P, y cuando el sustrato no es limitante.
 La relación kcat/Km es útil para comparar las actividades de enzimas diferentes. También es posible evaluar la eficiencia de una enzima midiendo su capacidad catalítica. Este valor es igual a la constante de velocidad de una reacción en presencia de la enzima (kcat/Km) dividida entre la constante de velocidad de la misma reacción en ausencia de la enzima (kn). Es de sorprender que sólo se conozcan pocos valores de eficiencia catalítica porque la mayor parte de las reacciones químicas se efectúa con lentitud extrema en ausencia de las enzimas —con tanta lentitud que sus velocidades sin enzima son muy difíciles de medir. Con frecuencia, las velocidades de reacción se miden en recipientes especiales de vidrio encerrados en acero a temperaturas mayores de 300°C.
La relación kcat/Km es útil para comparar las actividades de enzimas diferentes. También es posible evaluar la eficiencia de una enzima midiendo su capacidad catalítica. Este valor es igual a la constante de velocidad de una reacción en presencia de la enzima (kcat/Km) dividida entre la constante de velocidad de la misma reacción en ausencia de la enzima (kn). Es de sorprender que sólo se conozcan pocos valores de eficiencia catalítica porque la mayor parte de las reacciones químicas se efectúa con lentitud extrema en ausencia de las enzimas —con tanta lentitud que sus velocidades sin enzima son muy difíciles de medir. Con frecuencia, las velocidades de reacción se miden en recipientes especiales de vidrio encerrados en acero a temperaturas mayores de 300°C.
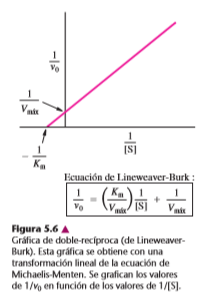
Medición de Km y Vmáx
 Los parámetros cinéticos de una reacción enzimática pueden producir información valiosa acerca de la especificidad y el mecanismo de la reacción. Los parámetros clave son Km y Vmáx ya que kcat se puede calcular si se conoce Vmáx.
Los parámetros cinéticos de una reacción enzimática pueden producir información valiosa acerca de la especificidad y el mecanismo de la reacción. Los parámetros clave son Km y Vmáx ya que kcat se puede calcular si se conoce Vmáx.
Los datos de Km y Vmáx para una reacción catalizada por enzima se pueden determinar de diversas maneras. Es posible obtener ambos valores por análisis de las velocidades iniciales en una serie de concentraciones de sustrato y una concentración fija de enzima. Para obtener valores fiables de las constantes cinéticas, los puntos de [S] se deben extender por abajo y por arriba de Km para producir una hipérbola. Es difícil determinar Km o Vmáx en forma directa con una gráfica de velocidad inicial en función de la concentración porque la curva tiende a la Vmáx en forma asintótica. Sin embargo, se pueden determinar valores exactos usando un programa de cómputo adecuado para ajustar los resultados experimentales a la ecuación de la hipérbola.
La ecuación de Michaelis-Menten se puede reacomodar para obtener valores de Vmáx y Km a partir de líneas rectas en gráficas. La transformación de uso más frecuente es la gráfica de doble recíproco, o de Lineweaver-Burk, en la que se grafican los valores de 1/y0 contra los de 1/[S] (figura 5.6). El valor absoluto de 1/Km se obtiene con la intersección de la recta con el eje x (es decir, la abscisa al origen), y el valor de 1/Vmáx se obtiene con la ordenada al origen. Aunque las gráficas de doble recíproco no son los métodos más exactos para determinar las constantes cinéticas, se comprenden con facilidad y permiten contar con pautas reconocibles para estudiar la inhibición enzimática, un aspecto de extrema importancia en la enzimología que en breve se examinará. Se pueden obtener valores de kcat con mediciones de Vmáx sólo cuando se conoce la concentración absoluta de la enzima. Se pueden determinar los valores de Km aun con enzimas que no hayan sido purificadas siempre y cuando sea una sola la enzima en la preparación impura la que pueda catalizar la reacción observada.
Cinética de las reacciones con sustratos múltiples
 Las reacciones de multisustrato pueden efectuarse de acuerdo con varios y distintos esquemas cinéticos llamados mecanismos cinéticos porque se deducen en su totalidad mediante experimentos cinéticos. Como se muestra en la figura 5.7, la secuencia de pasos va de izquierda a derecha. La adición de moléculas de sustrato (A, B, C, …) a la enzima y la liberación de productos (P, Q, R, …) desde la enzima se indican con flechas que apuntan hacia (unión de sustrato) o desde (liberación de producto) de la recta. Las diversas formas de la enzima (E libre, complejos ES o complejos EP) se escriben abajo de una línea horizontal. Los complejos ES que sufren transformación química cuando el sitio activo está lleno se muestran entre paréntesis. Las reacciones consecutivas (o secuenciales) (figura 5.7a) requieren que todos los sustratos estén presentes para que se libere algún producto. Estas reacciones secuenciales pueden ser ordenadas, con un orden obligatorio de enlazamiento de sustratos y de liberación de productos. También pueden ser aleatorias, sin orden obligatorio de enlazamiento o liberación. En las reacciones ping-pong (figura 5.7b), se libera un producto antes de que se enlacen todos los sustratos. En una reacción ping-pong de bisustrato, se enlaza el primer sustrato, se altera la enzima por sustitución y se libera el primer producto, después de lo cual se une el segundo sustrato, la enzima alterada regresa a su forma original y se libera el segundo producto. Debido al enlazamiento covalente de una porción de un sustrato a la enzima, a veces al mecanismo de ping-pong se le llama mecanismo de enzima sustituida. La unión y liberación de ligandos en un mecanismo de ping-pong se suelen indicar con líneas inclinadas. Las dos formas de la enzima se representan por E (no sustituida) y F (sustituida).
Las reacciones de multisustrato pueden efectuarse de acuerdo con varios y distintos esquemas cinéticos llamados mecanismos cinéticos porque se deducen en su totalidad mediante experimentos cinéticos. Como se muestra en la figura 5.7, la secuencia de pasos va de izquierda a derecha. La adición de moléculas de sustrato (A, B, C, …) a la enzima y la liberación de productos (P, Q, R, …) desde la enzima se indican con flechas que apuntan hacia (unión de sustrato) o desde (liberación de producto) de la recta. Las diversas formas de la enzima (E libre, complejos ES o complejos EP) se escriben abajo de una línea horizontal. Los complejos ES que sufren transformación química cuando el sitio activo está lleno se muestran entre paréntesis. Las reacciones consecutivas (o secuenciales) (figura 5.7a) requieren que todos los sustratos estén presentes para que se libere algún producto. Estas reacciones secuenciales pueden ser ordenadas, con un orden obligatorio de enlazamiento de sustratos y de liberación de productos. También pueden ser aleatorias, sin orden obligatorio de enlazamiento o liberación. En las reacciones ping-pong (figura 5.7b), se libera un producto antes de que se enlacen todos los sustratos. En una reacción ping-pong de bisustrato, se enlaza el primer sustrato, se altera la enzima por sustitución y se libera el primer producto, después de lo cual se une el segundo sustrato, la enzima alterada regresa a su forma original y se libera el segundo producto. Debido al enlazamiento covalente de una porción de un sustrato a la enzima, a veces al mecanismo de ping-pong se le llama mecanismo de enzima sustituida. La unión y liberación de ligandos en un mecanismo de ping-pong se suelen indicar con líneas inclinadas. Las dos formas de la enzima se representan por E (no sustituida) y F (sustituida).- Inhibición reversible de enzimas
Un inhibidor de enzimas (I) es un compuesto que se enlaza con una enzima e interfiere con su actividad. Los inhibidores pueden actuar evitando la formación del complejo ES o bloqueando la reacción química que lleva a la formación del producto. Por regla general, los inhibidores son moléculas pequeñas que se unen en forma reversible con la enzima que inhiben.
Algunos inhibidores se unen en forma covalente con las enzimas y causando que la inhibición sea irreversible. La mayor parte de la inhibición de relevancia biológica es reversible. Los inhibidores reversibles se unen a las enzimas con las mismas fuerzas no covalentes que enlazan a sustratos y productos. El equilibrio entre la enzima libre (E) más el inhibidor (I) y el complejo EI se caracteriza por una constante de disociación. En este caso, a la constante se le llama constante de inhibición, Ki.
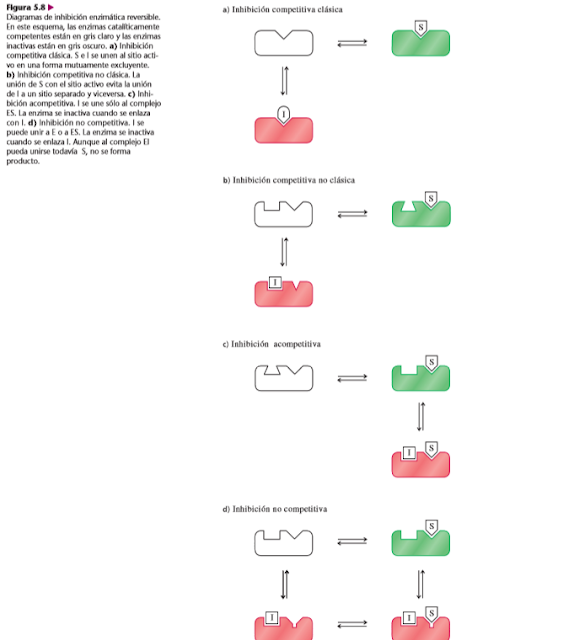
Los tipos básicos de inhibición reversible son competitiva, acompetitiva y no competitiva. Se pueden diferenciar de manera experimental por sus efectos sobre el comportamiento cinético de las enzimas.
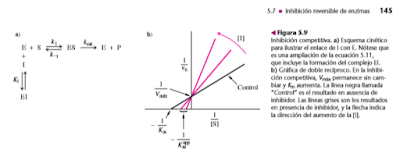
A.Inhibición competitiva
En la inhibición competitiva, el inhibidor sólo se puede unir a moléculas de enzima libre que no estén unidas a sustrato alguno. Cuando un inhibidor competitivo se une con una molécula de enzima, una molécula de sustrato no puede unirse a esa molécula de enzima. Al revés, la unión de sustrato y una molécula de enzima evita el enlazamiento de un inhibidor. En otras palabras, S e I compiten por unirse a la molécula de enzima. Más comúnmente, S e I se unen al mismo sitio de la enzima, el sitio activo. Este tipo de inhibición se llama inhibición competitiva clásica. No es la única clase de inhibición competitiva. En algunos casos, como en las enzimas alostéricas, el inhibidor se une a un sitio diferente, lo que altera el sitio de unión del sustrato y evita esta unión . A este tipo de inhibición se le llama inhibición competitiva no clásica.
En consecuencia, la velocidad máxima es la misma en presencia o en ausencia de un inhibidor. Mientras más inhibidor competitivo esté presente, se necesitará más sustrato para llegar a la mitad de la saturación. Ha sido demostrado que la concentración de sustrato correspondiente a la mitad de saturación es la Km. Así, en presencia de concentraciones crecientes de un inhibidor competitivo, aumenta la Km. Muchos inhibidores competitivos clásicos son análogos al sustrato, compuestos que se parecen en su estructura a los sustratos. Los análogos se unen a la enzima, pero no reaccionan. Por ejemplo, la benzamidina es un inhibidor competitivo de la tripsina. La tripsina cataliza la hidrólisis de los enlaces peptídicos cuyos grupos carbonilo contienen residuos de arginina y lisina, y la benzamidina es un análogo de la cadena lateral de alquilguanidilo en la arginina. La benzamidina actúa como inhibidor que compite con los residuos de arginina en péptidos por la unión de la tripsina.
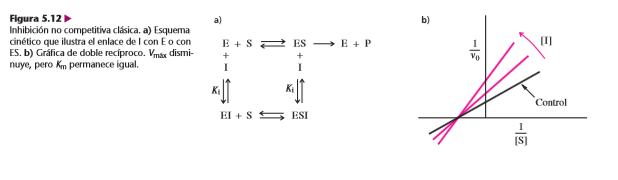
C. Inhibición no competitiva
Los inhibidores no competitivos se pueden unir a la E o al ES y formar complejos inactivos EI o ESI, respectivamente. Esos inhibidores no son análogos del sustrato y no se enlazan en el mismo sitio que el S. El caso clásico de inhibición no competitiva se caracteriza por una disminución aparente de Vmáx (1/Vmáx parece aumentar) sin cambiar de la Km. En una gráfica de doble recíproco, las líneas de la inhibición no competitiva clásica se cruzan en el punto del eje x que corresponde a –1/Km. Esta ordenada al origen común indica que Km no se afecta.
La mayor parte de las enzimas no se apega a la forma clásica de inhibición no competitiva, donde no cambia Km. En la mayoría de los casos se afectan tanto la Vmáx como la Km, ya que la afinidad del inhibidor hacia la E es distinta que hacia ES. En esos casos se suelen llamar de inhibición mixta.
La industria farmacéutica recurre a estudios de inhibición enzimática para diseñar medicamentos de uso clínico. En muchos casos se usa un inhibidor natural de una enzima como punto de partida para diseñar un medicamento. En lugar de usar síntesis aleatorias y determinar inhibidores potenciales, algunos investigadores están recurriendo a un método más eficiente llamado diseño racional de un fármaco. En teoría, con el banco de conocimientos tan amplio acerca de la estructura de las enzimas, hoy pueden diseñarse inhibidores en forma racional que se ajusten al sitio activo de determinada enzima. Los efectos de un compuesto sintético se determinan primero en enzimas aisladas, y después en sistemas biológicos. Aun cuando un compuesto desarrolle una actividad inhibidora adecuada, se pueden encontrar otros problemas.


1. Las actividades de las enzimas alostéricas cambian debido a inhibidores y activadores metabólicos. Con frecuencia, dichos moduladores alostéricos no se parecen a los sustratos o a los productos de la enzima. Por ejemplo, el fosfoenolpiruvato no se parece al sustrato ni al producto de la fosfofructocinasa. Una consideración de las diferencias estructurales entre sustratos e inhibidores metabólicos llevó originalmente, a la conclusión de que los moduladores alostéricos están unidos a sitios reguladores, separados de los sitios catalíticos.
2. Los moduladores alostéricos se enlazan en forma no covalente a las enzimas que regulan. (Hay un grupo especial de enzimas reguladoras cuyas actividades son controladas por modificación covalente y se describen en la sección 5.10D). Muchos moduladores alteran la Km de la enzima para un sustrato; otros, la Vmáx de la enzima. Los moduladores mismos no son alterados químicamente por la enzima.
3. Con pocas excepciones, las enzimas reguladoras son proteínas de subunidades múltiples. (Sin embargo, no todas las enzimas de subunidades múltiples son reguladoras). Las cadenas polipeptídicas individuales de una enzima reguladora pueden ser idénticas o diferentes. Para aquellas enzimas que tienen subunidades idénticas (como la fosfofructocinasa-1 de E. coli), cada cadena polipeptídica puede contener los sitios catalítico y regulador a la vez y el oligómero es un complejo simétrico que con frecuencia posee dos o cuatro cadenas de proteína. Las enzimas reguladoras formadas por subunidades diferentes tienen ordenamientos más complejos, pero en general simétricos.
4. Toda enzima sujeta a regulación alostérica posee cuando menos un sustrato para el cual la curva de v0 en función del [S] es sigmoidea en lugar de hiperbólica. La fosfofructocinasa-1 exhibe una cinética de Michaelis-Menten (hiperbólica) con respecto a un sustrato, ATP, pero cinética sigmoidea en relación con su otro sustrato, el 6-fosfato de fructosa. La curva sigmoidea es causada por la cooperación positiva del enlace del sustrato, lo cual es posible por la presencia de múltiples sitios de enlace del sustrato en la enzima.
Mecanismos Enzimáticos
Pueden ser por:
A.Sustituciones nucleofílicas
B. Reacciones de ruptura
C. Reacciones de oxido-reducción
Donde los medos quimico de la catalisis enzimática puede ser de tipo:
A. Residuos polares de aminoácidos en sitios activos
B. Catálisis ácido-base
C. Catálisis covalente
D. Influencia del pH sobre las velocidades de reacción enzimática
Reacciones controladas por difusión
Unas pocas enzimas catalizan reacciones a velocidades que se aproximen al límite físico superior de las reacciones en solución. Este límite superior teórico es la velocidad de difusión de los reactivos cercanos uno a otro. Una reacción que se produce con cada choque entre moléculas de reactivos se llama reacción controlada por difusión.
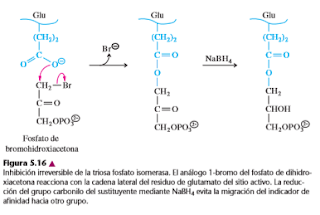
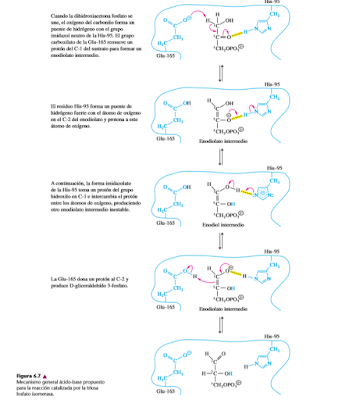
A. Triosa fosfato isomeras: La triosa fosfato isomerasa cataliza la interconversión rápida de la dihidroxiacetona fosfato (DHAP) y el gliceraldehído 3-fosfato(G3P) en las rutas de la glicólisis y la gluconeogénesis.
Lisozima
La lisozima cataliza la hidrólisis de algunos polisacáridos, en especial los que forman las paredes celulares de las bacterias. Es la primera enzima cuya estructura fue resuelta, y por esta razón ha habido un interés duradero en desarrollar su mecanismo preciso de acción. Muchas secreciones como lágrimas, saliva y moco nasal, contienen actividad de lisozima para ayudar a evitar infecciones bacterianas. (La lisozima causa la lisiso ruptura de las células bacterianas). La lisozima mejor estudiada es la de la clara de huevo de gallina. El sustrato de la lisozima es un polisacárido formado por residuos alternantes de N-acetilglucosamina (GlcNAc) y ácido N-acetilmurámico (MurNAc) unidos por enlaces glicosídicos (figura 6.17). En forma específica, la lisozima cataliza la hidrólisis del enlace glicosídico entre el C-1 del residuo MurNAc y el átomo de oxígeno en el C-4 de un residuo de GlcNAc.
Coenzimas y Vitaminas
Hay dos tipos de cofactores: los iones esenciales (principalmente iones metálicos) y los compuestos orgánicos llamados coenzimas. Los cofactores, tanto inorgánicos como orgánicos, se transforman en partes esenciales de los sitios activos de ciertas enzimas.
Clasificación de las coenzimas
Se puede clasificar a las coenzimas en dos tipos, según la forma en que interactúan con la apoenzima. Las coenzimas de un tipo, llamadas cosustratos, con frecuenciaen realidad son sustratos en reacciones catalizadas por enzimas. Un cosustrato se altera durante la reacción y se disocia del sitio activo. La estructura original del cosustrato se regenera en una reacción posterior, catalizada por otra enzima. El cosustrato se recicla en forma repetida dentro de la célula, a diferencia de un sustrato ordinario, cuyo producto, en el caso típico, sufre una transformación posterior. Los cosustratos llevan y traen grupos metabólicos entre distintas reacciones catalizadas por enzimas.
B. Inhibición acompetitiva
Los inhibidores acompetitivos sólo se unen al ES y no a la enzima libre. En la inhibición acompetitiva disminuye la Vmáx (aumenta 1/Vmáx) por conversión de algunas moléculas de E en la forma inactiva ESI. Ya que es el complejo ES el que se enlaza con I y la disminución de Vmáx no se revierte por la adición de más sustrato. También, los inhibidores acompetitivos hacen descender la Km (vista como un aumento del valor absoluto de 1/Km en una gráfica de doble recíproco) ya que los equilibrios de formación de ES y de ESI son desplazados hacia los complejos, por la unión de I.
Los inhibidores no competitivos se pueden unir a la E o al ES y formar complejos inactivos EI o ESI, respectivamente. Esos inhibidores no son análogos del sustrato y no se enlazan en el mismo sitio que el S. El caso clásico de inhibición no competitiva se caracteriza por una disminución aparente de Vmáx (1/Vmáx parece aumentar) sin cambiar de la Km. En una gráfica de doble recíproco, las líneas de la inhibición no competitiva clásica se cruzan en el punto del eje x que corresponde a –1/Km. Esta ordenada al origen común indica que Km no se afecta.
La mayor parte de las enzimas no se apega a la forma clásica de inhibición no competitiva, donde no cambia Km. En la mayoría de los casos se afectan tanto la Vmáx como la Km, ya que la afinidad del inhibidor hacia la E es distinta que hacia ES. En esos casos se suelen llamar de inhibición mixta.
La inhibición enzimática reversible permite contar con un método poderoso para determinar la actividad enzimática y para alterarla en el tratamiento de enfermedades. Se puede obtener información acerca de la forma y de la reactividad química del sitio activo de una enzima a partir de experimentos que impliquen una serie de inhibidores competitivos con estructuras alteradas en forma sistemática.
La industria farmacéutica recurre a estudios de inhibición enzimática para diseñar medicamentos de uso clínico. En muchos casos se usa un inhibidor natural de una enzima como punto de partida para diseñar un medicamento. En lugar de usar síntesis aleatorias y determinar inhibidores potenciales, algunos investigadores están recurriendo a un método más eficiente llamado diseño racional de un fármaco. En teoría, con el banco de conocimientos tan amplio acerca de la estructura de las enzimas, hoy pueden diseñarse inhibidores en forma racional que se ajusten al sitio activo de determinada enzima. Los efectos de un compuesto sintético se determinan primero en enzimas aisladas, y después en sistemas biológicos. Aun cuando un compuesto desarrolle una actividad inhibidora adecuada, se pueden encontrar otros problemas.
Uno de los productos obtenidos
mediante el uso de enzimas son los aminoácidos. Si bien se pueden sintetizar
empleando un proceso químico, el resultado es una mezcla de dos tipos distintos
(D y L isómeros). Puesto que solamente el L-isómero es biológicamente activo,
la mezcla debe ser separada en sus dos componentes.
Además de aminoácidos, las
enzimas son utilizadas para la producción de antibióticos semi-sintéticos.
 Las
penicilinas semisintéticas son los principales productos farmacéuticos
obtenidos por tecnología enzimática.
Las
penicilinas semisintéticas son los principales productos farmacéuticos
obtenidos por tecnología enzimática.
Las Penicilinas
Fórmula:
Cada frasco con polvo
contiene:
* Penicilina G Sódica
2.500.000 U.I.
* Penicilina G Procaínica
1.250.000 U.I.
* Penicilina G Benzatínica
1.250.000 U.I.
* Sulfato de estreptomicina
2 g
* Citrato de sodio anhidro
0,004 g
* Dipirona 1 g
Cada frasco con 25 ml de
solvente contiene:
* Clorhidrato de Lidocaína
0,06 g
* Agentes de Formulación
c.s.
Dosificación:10.000 a 20.000 U.I. de
Penicilina por k. p. v. según la gravedad de la afección. Esta dosis puede
repetirse a las 24-48 horas, según criterio profesional.
Arko Enzimas
Arkoenzimas Lactosa Digest
Cápsulas: Enzima digestiva que ayuda a
digerir mejor la lactosa.
Propiedades: Arkoenzimas Lactosa Digest
ayuda a mantener el bienestar digestivo. Es rico en enzima lactasa y está
destinado a las personas que desean digerir mejor los alimentos que contienen
lactosa (leche, queso, productos lácteos).
Composición: Enzima lactasa.
Dosis: 3 cápsulas al día. 1 cápsula
15 minutos antes de cada comida que contenga lactosa.
También se utilizan enzimas en la
producción de esteroides. Los esteroides se utilizan en un gran número de
preparados farmacéuticos (por ejemplo en los antinflamatorios), por lo que los
procesos empleados en la producción de estas sustancias presentan una
considerable importancia económica.
Hidrocortisona
Forma farmacéutica y
formulación:
Succinato sódico de
hidrocortisona equivalente
a.................................. 100 y 500 mg
Cada ampolleta con diluyente
contiene:
Agua inyectable, 2 ml y 5
ml.
Cada 100 g de CREMA
contienen:
Aceponato de hidrocortisona
.......................................... 0.127 g
Indicaciones
terapéuticas: El succinato de HIDROCORTISONA está
indicado en las siguientes condiciones:
Trastornos
endocrinos: Insuficiencia adrenocortical primaria o secundaria
(hidrocortisona o cortisona es la primera elección), los análogos sintéticos
pueden ser usados en conjunción con mineralocorticoides cuando sean requeridos
(en la infancia, la suplementación con mineralocorticoides es de particular
importancia); hiperplasia adrenal congénita; tiroiditis no supurativa;
hipercalcemia asociada a cáncer; preoperativamente y en el evento de
enfermedad o trauma severo en pacientes con insuficiencia adrenal conocida, o
cuando la reserva adrenocortical es dudosa; estado de choque que no responde a
la terapia convencional, si existe o se sospecha una insuficiencia
adrenocortical.
Dermatopatías:
Pénfigo; dermatitis herpetiforme bulosa; eritema multiforme severo (síndrome de
Stevens-Johnson); dermatitis exfoliativa; micosis fungoides; psoriasis severa;
dermatitis seborreica severa.
Contraindicaciones: Hidrocortisona está
contraindicada en las micosis sistémicas, estados convulsivos, psicosis grave,
úlcera péptica activa, hipersensibilidad a cualquier componente de la fórmula.
Algunas marcas o formulaciones están contraindicadas en prematuros por su contenido
en benzilalcohol, el cual se ha asociado con un “síndrome de jadeo” fatal.
Agua inyectable, 2 y 8 ml.
 Los glucocorticoides naturales
(hidrocortisona y cortisona), que también tienen propiedades de retención de
sal, se usan como terapia de reemplazo en estados de deficiencia
adrenocortical.
Los glucocorticoides naturales
(hidrocortisona y cortisona), que también tienen propiedades de retención de
sal, se usan como terapia de reemplazo en estados de deficiencia
adrenocortical.
Metilprednisolona
FORMA FARMACÉUTICA Y
FORMULACIÓN:
Cada frasco ámpula contiene:
Succinato sódico de
metilprednisolona
equivalente a.............................. 80 y 500 mg
INDICACIONES TERAPÉUTICAS:
METILPREDNISOLONA es un
glucocorticoide.
Los glucocorticoides son
esteroides adrenocorticales tanto naturales como sintéticos, que se absorben
rápidamente en el tracto gastrointestinal.
 Los glucocorticoides naturales
(hidrocortisona y cortisona), que también tienen propiedades de retención de
sal, se usan como terapia de reemplazo en estados de deficiencia
adrenocortical.
Los glucocorticoides naturales
(hidrocortisona y cortisona), que también tienen propiedades de retención de
sal, se usan como terapia de reemplazo en estados de deficiencia
adrenocortical.
Sus análogos sintéticos se
usan principalmente por sus potentes efectos antiinflamatorios en trastornos de
muchos sistemas de órganos.
Los glucocorticoides causan
profundos y variados efectos metabólicos. Además, modifican las respuestas
inmunes del organismo a diversos estímulos.
Está indicado el uso
intravenoso o intramuscular del polvo estéril de succinato sódico de
METILPREDNISOLONA en las siguientes condiciones:
Trastornos endocrinos:
Insuficiencia adrenocortical primaria o secundaria (la hidrocortisona o la
cortisona son los fármacos de primera elección; si se aplica, se pueden usar
análogos sintéticos junto con mineralocorticoides; en la infancia es de
particular importancia la administración de complementos de
mineralocorticoides), hiperplasia adrenal congénita, tiroiditis no
supurativa, hipercalcemia asociada con cáncer. El succinato sódico de
METILPREDNISOLONA en polvo también está indicado en choque que no responde a la
terapia convencional, si existe o se sospecha insuficiencia adrenocortical.
Trastornos reumáticos: Como
terapia auxiliar para la administración a corto plazo (para ayudar al paciente
en un episodio agudo o exacerbación) en artritis psoriásica, artritis
reumatoidea, incluyendo artritis reumatoidea juvenil (algunos casos pueden
requerir terapia de mantenimiento con dosis bajas), espondilitis anquilosante,
bursitis aguda y subaguda, tendosinovitis aguda no específica, artritis gotosa
aguda, osteoartritis postraumática, sinovitis de osteoartritis,
epicondilitis.
Enfermedades del colágeno:
Durante una exacerbación o como terapia de mantenimiento en casos seleccionados
de lupus eritematoso sistémico, carditis reumática aguda, dermatomiositis
sistémica (polimiositis).
Enfermedades dermatológicas:
Pénfigo, dermatitis ampollosa herpetiforme, eritema multiforme severo
(síndrome de Stevens-Johnson), dermatitis exfoliativa, micosis fungoides,
psoriasis severa, dermatitis seborreica severa.
Inhibición enzimática irreversible
un inhibidor enzimático irreversible forma un enlace covalente estable con una molécula de enzima y elimina así las moléculas del sitio activo en la población enzimática. Típicamente, la inhibición irreversible ocurre por alquilación o acilación de la cadena lateral de un residuo de aminoácido en el sitio activo. Hay muchos inhibidores irreversibles naturales.
Una aplicación importante de los inhibidores irreversibles es la identificación de residuos de aminoácidos en el sitio activo, por sustitución específica de sus cadenas laterales reactivas. En este proceso, un inhibidor irreversible que sólo reacciona con un tipo de aminoácido se incuba con una solución de la enzima, la que a continuación es analizada para determinar su pérdida de actividad. Las cadenas laterales ionizables se modifican con reacciones de acilación o alquilación.
Enzimas alostéricas
Las enzimas alostéricas son enzimas cuyas propiedades son afectadas por cambios en la estructura. Los cambios estructurales son ocasionados por interacción con moléculas pequeñas. Con frecuencia, las enzimas alostéricas no presentan cinética clásica de Michaelis-Menten debido a su unión cooperativa del sustrato, como el caso de la hemoglobina, que no es enzima.
Propiedades generales de las enzimas alostéricas
La examinación de las propiedades cinéticas y físicas de las enzimas alostéricas ha demostrado que poseen las siguientes características generales:
2. Los moduladores alostéricos se enlazan en forma no covalente a las enzimas que regulan. (Hay un grupo especial de enzimas reguladoras cuyas actividades son controladas por modificación covalente y se describen en la sección 5.10D). Muchos moduladores alteran la Km de la enzima para un sustrato; otros, la Vmáx de la enzima. Los moduladores mismos no son alterados químicamente por la enzima.
3. Con pocas excepciones, las enzimas reguladoras son proteínas de subunidades múltiples. (Sin embargo, no todas las enzimas de subunidades múltiples son reguladoras). Las cadenas polipeptídicas individuales de una enzima reguladora pueden ser idénticas o diferentes. Para aquellas enzimas que tienen subunidades idénticas (como la fosfofructocinasa-1 de E. coli), cada cadena polipeptídica puede contener los sitios catalítico y regulador a la vez y el oligómero es un complejo simétrico que con frecuencia posee dos o cuatro cadenas de proteína. Las enzimas reguladoras formadas por subunidades diferentes tienen ordenamientos más complejos, pero en general simétricos.
4. Toda enzima sujeta a regulación alostérica posee cuando menos un sustrato para el cual la curva de v0 en función del [S] es sigmoidea en lugar de hiperbólica. La fosfofructocinasa-1 exhibe una cinética de Michaelis-Menten (hiperbólica) con respecto a un sustrato, ATP, pero cinética sigmoidea en relación con su otro sustrato, el 6-fosfato de fructosa. La curva sigmoidea es causada por la cooperación positiva del enlace del sustrato, lo cual es posible por la presencia de múltiples sitios de enlace del sustrato en la enzima.
Mecanismos Enzimáticos
Pueden ser por:
A.Sustituciones nucleofílicas
B. Reacciones de ruptura
C. Reacciones de oxido-reducción
Donde los medos quimico de la catalisis enzimática puede ser de tipo:
A. Residuos polares de aminoácidos en sitios activos
B. Catálisis ácido-base
C. Catálisis covalente
D. Influencia del pH sobre las velocidades de reacción enzimática
Reacciones controladas por difusión
Unas pocas enzimas catalizan reacciones a velocidades que se aproximen al límite físico superior de las reacciones en solución. Este límite superior teórico es la velocidad de difusión de los reactivos cercanos uno a otro. Una reacción que se produce con cada choque entre moléculas de reactivos se llama reacción controlada por difusión.
A. Triosa fosfato isomeras: La triosa fosfato isomerasa cataliza la interconversión rápida de la dihidroxiacetona fosfato (DHAP) y el gliceraldehído 3-fosfato(G3P) en las rutas de la glicólisis y la gluconeogénesis.
Lisozima
La lisozima cataliza la hidrólisis de algunos polisacáridos, en especial los que forman las paredes celulares de las bacterias. Es la primera enzima cuya estructura fue resuelta, y por esta razón ha habido un interés duradero en desarrollar su mecanismo preciso de acción. Muchas secreciones como lágrimas, saliva y moco nasal, contienen actividad de lisozima para ayudar a evitar infecciones bacterianas. (La lisozima causa la lisiso ruptura de las células bacterianas). La lisozima mejor estudiada es la de la clara de huevo de gallina. El sustrato de la lisozima es un polisacárido formado por residuos alternantes de N-acetilglucosamina (GlcNAc) y ácido N-acetilmurámico (MurNAc) unidos por enlaces glicosídicos (figura 6.17). En forma específica, la lisozima cataliza la hidrólisis del enlace glicosídico entre el C-1 del residuo MurNAc y el átomo de oxígeno en el C-4 de un residuo de GlcNAc.
Hay dos tipos de cofactores: los iones esenciales (principalmente iones metálicos) y los compuestos orgánicos llamados coenzimas. Los cofactores, tanto inorgánicos como orgánicos, se transforman en partes esenciales de los sitios activos de ciertas enzimas.
Clasificación de las coenzimas
Se puede clasificar a las coenzimas en dos tipos, según la forma en que interactúan con la apoenzima. Las coenzimas de un tipo, llamadas cosustratos, con frecuenciaen realidad son sustratos en reacciones catalizadas por enzimas. Un cosustrato se altera durante la reacción y se disocia del sitio activo. La estructura original del cosustrato se regenera en una reacción posterior, catalizada por otra enzima. El cosustrato se recicla en forma repetida dentro de la célula, a diferencia de un sustrato ordinario, cuyo producto, en el caso típico, sufre una transformación posterior. Los cosustratos llevan y traen grupos metabólicos entre distintas reacciones catalizadas por enzimas.
ATP y otros cosustratos nucleótidos
Hay varios trifosfatos nucleósidos que son coenzimas. Con mucho, el más abundante es el trifosfato de adenosina (ATP, adenosine triphosphate). Entre otros ejemplos frecuentes están el GTP, la S-adenosilmetionina y azúcares nucleótido, como la difosfato de uridina glucosa (UDP-glucosa). El ATP es un reactivo versátil que puede donar sus grupos fosforilo, pirofosforilo, adenililo (AMP) o adenosilo en reacciones de transferencia de grupo.
NAD+ y NADP+
FAD y FMN
Las coenzimas flavina adenina dinucleótido (FAD) y flavina mononucleótido (FMN) se derivan de la riboflavina o vitamina B2. La riboflavina es sintetizada por bacterias, protistas, hongos, plantas y algunos animales. Los mamíferos obtienen riboflavina de su alimento. La riboflavina está formada por ribitol, un alcohol con cinco carbonos unido al átomo N-10 de un sistema de anillo heterocíclico llamado isoaloxazina. Igual que el y el el FAD contiene AMP y un enlace de pirofosfato.
Vitaminas lipídicas
Las estructuras de las cuatro vitaminas lipídicas (A, D, E y K) contienen anillos y largas cadenas laterales alifáticas. Las vitaminas lipídicas son muy hidrofóbicas, aunque cada una posee cuando menos un grupo polar. Al ingerirse son absorbidas en el intestino por un proceso parecido a la absorción de otros nutrientes lípidos . Después de digerir toda la proteína que pueda estar unida a ellas, son arrastradas a la interfase celular del intestino en forma de micelas formadas con sales biliares.
Carbohidratos
Los carbohidratos (también llamados sacáridos), con base en su masa, son la clase más abundante de moléculas biológicas en la Tierra. Aunque todos los organismos pueden sintetizar carbohidratos, muchos de ellos se producen en organismos fotosintéticos, como bacterias, algas y plantas. Estos organismos convierten la energía solar en energía química, que a continuación se usa para fabricar carbohidratos a partir de dióxido de carbono. Los carbohidratos tienen varios papeles fundamentales en los organismos vivos. En animales y plantas, los carbohidratos poliméricos funcionan como moléculas almacenadoras de energía. Los animales pueden ingerir carbohidratos, que a continuación se puedan oxidar para obtener energía para los procesos metabólicos. También se encuentran carbohidratos poliméricos en las paredes celulares y en los recubrimientos protectores de muchos organismos; otros carbohidratos polímeros son moléculas marcadoras que permiten que un tipo de célula reconozca e interaccione con otro tipo. Los derivados de carbohidratos se encuentran en varias moléculas biológicas, como algunas coenzimas y en los ácidos nucleicos ADN y ARN.
Se pueden describir los carbohidratos por la cantidad de unidades monómeras que contienen:
Los monosacáridos son las unidades más pequeñas de estructura de carbohidratos. El nombre carbohidrato, “hidrato de carbono”, indica que su fórmula empírica es (CH2O)n, donde n es 3 o más (en general n es 5 o 6, pero puede ser hasta 9).
Los oligosacáridos son polímeros con dos hasta unos 20 residuos de monosacárido. Los oligosacáridos más comunes son los disacáridos, formados por dos residuos de monosacárido unidos.
Los polisacáridos son polímeros que contienen muchos (en general más de 20) residuos de monosacárido.
Los oligosacáridos y los polisacáridos no tienen la fórmula empírica (CH2O)n, porque durante la formación del polímero se elimina agua. El término glucano (o glicano) es uno más general que se usa para los carbohidratos polímeros. Puede indicar un polímero de azúcares idénticos (homoglicano) o de distintos azúcares (heteroglicano).
Los glucoconjugados son derivados de carbohidrato en los que una o más cadenas de carbohidrato están unidas en forma covalente a un péptido, una proteína o un lípido. Esos derivados comprenden los proteoglicanos, peptidoglicanos, glucoproteínas y glucolípidos.
La mayor parte de los monosacáridos son compuestos quirales
Los monosacáridos son sólidos blancos, cristalinos y solubles en agua que tienen sabor dulce. Entre los ejemplos están la glucosa y la fructosa. Desde el punto de vista químico, los monosacáridos son polihidroxi aldehídos o aldosas, o polihidroxi cetonas o cetosas. Se clasifican por el tipo de grupo carbonilo y por la cantidad de átomos de carbono. Como regla, se usa el sufijo -osa para dar nombre a los carbohidratos, aunque hay varias excepciones. Todos los monosacáridos tienen al menos tres átomos de carbono. Uno de ellos es el carbono carbonílico, y cada uno de los restantes tiene un grupo hidroxilo. En las aldosas, el átomo de carbono más oxidado se designa como C-1 y se pone en la parte superior de una proyección de Fischer. En las cetosas, el átomo de carbono más oxidado suele ser el C-2.
Se puede considerar que las aldosas y las cetosas más largas son prolongaciones del gliceraldehído y la dihidroxiacetona, respectivamente, y que los grupos quirales H—C—OH están insertados entre el carbono carbonílico y el grupo alcohol primario.
La lista completa de los nombres y estructuras de las tetrosas (aldosas de cuatro carbonos), pentosas (aldosas de cinco carbonos) y hexosas (aldosas de seis carbonos) relacionadas con el D-gliceraldehído.
Los átomos de carbono se numeran a partir del carbono aldehídico, al que se le asigna el número 1. Por convención, se dice que los azúcares tienen la configuración D cuando la configuración del carbono quiral que tiene el número mayor, o sea el carbono quiral más alejado del carbono carbonílico, es la misma que la del C-2 del D-gliceraldehído (es decir, el grupo —OH está unido a este átomo de carbono en el lado derecho en una proyección de Fischer).
Cuando las moléculas de azúcar tienen distinta configuración sólo en uno de varios centros quirales, se llaman epímeros. Por ejemplo, la D-manosa y la D-galactosa son epímeros de la D-glucosa (en C-2 y C-4, respectivamente), aunque no son epímeros entre sí.
Las cetosas de cadena larga se relacionan con la dihidroxiacetona de la misma manera que las aldosas de cadena larga se relacionan con el gliceraldehído. Una cetosa tiene un átomo de carbono quiral menos que la aldosa con la misma fórmula empírica.
Ciclación de aldosas y hexosas
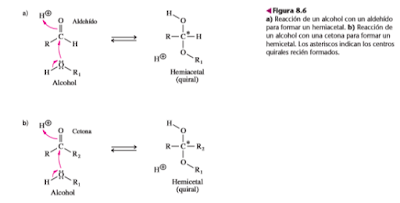
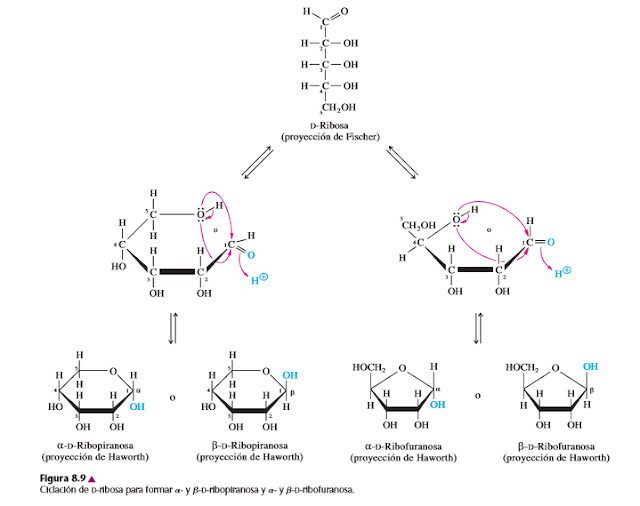
El comportamiento óptico de algunos monosacáridos parece indicar que tienen un átomo de carbono más que lo que se ve en las estructuras de las figuras 8.3 y 8.5. Por ejemplo, la D-glucosa tiene dos formas que contienen cinco (no cuatro) carbonos asimétricos. La causa de esta asimetría adicional es una reacción de ciclación intramolecular, que produce un nuevo centro quiral en el átomo de carbono del grupo carbonilo. Esta ciclación se parece a la reacción de un alcohol con un aldehído para formar un hemiacetal, o con una cetona para formar un hemicetal.
El carbono carbonílico de una aldosa que contenga al menos cinco átomos de carbono, o de una cetosa que contenga al menos seis átomos de carbono, puede reaccionar con un grupo hidroxilo intramolecular y formar un hemiacetal cíclico o un hemicetal cíclico, respectivamente. El átomo de oxígeno del grupo hidroxilo reaccionante se convierte en miembro de las estructuras anulares con cinco o seis miembros.
Como se parece al compuesto heterocíclico pirano, de seis miembros, al anillo con seis miembros de un monosacárido se le llama piranosa. De igual modo, como el anillo con cinco miembros de un monosacárido se parece al del furano, se le llama furanosa. Sin embargo, a diferencia del pirano y del furano, los anillos de los carbohidrato no contienen dobles enlaces.
El carbono más oxidado de un monosacárido ciclado, el que está unido a dos átomos de oxígeno, se llama carbono anomérico. En las estructuras de anillo, el carbono anomérico es quiral. Así, la aldosa o cetosa ciclada puede adoptar cualquiera de dos configuraciones (designadas a o b) como se ve en la figura 8.8 para la D-glucosa. A los isómeros a y b se les llama anómeros.
Derivados de los monosacáridos
Entre estos derivados están los monosacáridos polimerizados, como los oligosacáridos y los polisacáridos, igual que varias clases de compuestos no polimerizados. En esta sección se presentarán algunos derivados de monosacárido, incluyendo fosfatos de azúcar, desoxi y aminoazúcares, azúcares alcoholes, azúcares ácidos y el ácido ascórbico (vitamina C).
A. Fosfatos de azúcar
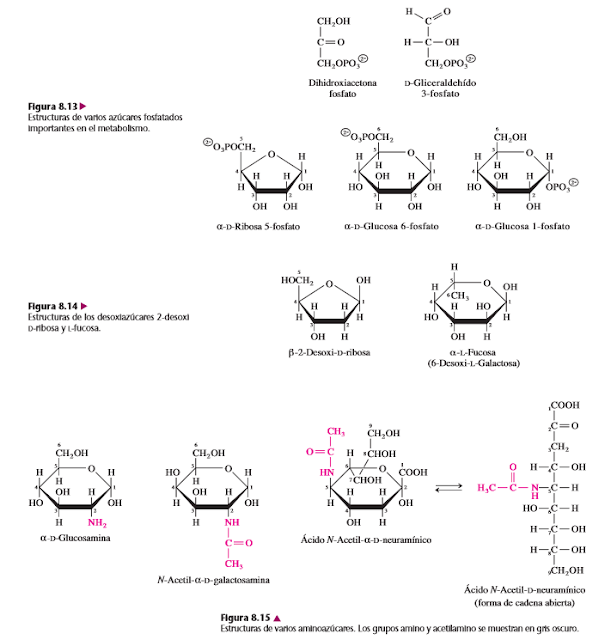
Los monosacáridos, en las vías metabólicas, con frecuencia se convierten en ésteres de fosfato. En la figura 8.13 se muestran las estructuras de varios fosfatos de azúcar con los que se encontrará al estudiar el metabolismo de los carbohidratos. Los fosfatos de triosa, el 5-fosfato de ribosa y el 6-fosfato de glucosa son ésteres alcohol-fosfato simples. El 1-fosfato de glucosa es un fosfato de hemiacetal, más reactivo que un fosfato de alcohol. La capacidad de la UDP-glucosa para funcionar como donador de glucosilo (sección 7.7) es una prueba de esta reactividad.
B. Desoxiazúcares
En la figura 8.14 se muestran las estructuras de dos desoxiazúcares. En esos derivados, un átomo de hidrógeno sustituye a uno de los grupos hidroxilo del monosacárido precursor. La 2-desoxi-D-ribosa es un bloque constructivo importante en el ADN. La L-fucosa (6-desoxi-L-galactosa) está muy distribuida en plantas, animales y microorganismos. A pesar de su rara configuración L, la fucosa se deriva metabólicamente de la D-manosa.
C. Aminoazúcares
En varios azúcares, un grupo amino sustituye uno de los grupos hidroxilo del monosacárido precursor. A veces el grupo amino está acetilado. En la figura 8.15 se ven tres ejemplos de aminoazúcares. Los aminoazúcares de la glucosa y la galactosa se suelen presentar en glucoconjugados. El ácido N-acetilneuramínico (NeuNAc) se forma a partir de la N-acetilmanosamina y piruvato.
D. Azúcares alcoholes
En un azúcar alcohol el oxígeno carbonílico del monosacárido precursor se ha reducido y se produce un polihidroxialcohol. La figura 8.16 muestra tres ejemplos de azúcares alcoholes. La glicerina y el mio-inositol son componentes importantes de los lípidos. El ribitol es un componente de flavina mononucleótido (FMN) y flavina adenina dinucleótido (FAD). En general, los azúcares alcoholes reciben su nombre sustituyendo el sufijo -osa del monosacárido precursor por el de -itol.
E. Azúcares ácidos
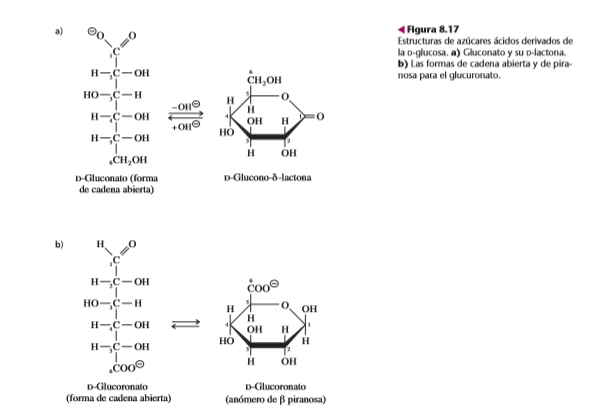
Los azúcares ácidos son ácidos carboxílicos derivados de las aldosas, sea por oxidación de C-1 (el carbono aldehídico) para formar un ácido aldónico, o por oxidación del carbono con número mayor (el que tiene el alcohol primario) para formar un ácido aldurónico. En la figura 8.17 se ven las estructuras de los derivados aldónicos y aldurónicos de la glucosa, gluconato y glucoronato. Los ácidos aldónicos existen en la forma de cadena abierta, en solución alcalina, y forman lactonas (ésteres intramoleculares) al acidularlos. Los ácidos aldónicos pueden estar como piranosas, por lo que poseen un carbono anomérico. El ácido N-acetilneuramínico (figura 8.15) es un ácido aldónico y a la vez un aminoazúcar.
Los azúcares ácidos son componentes importantes de muchos polisacáridos.
F. Ácido ascórbico
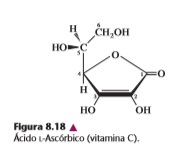
El ácido L-ascórbico (figura 8.18), o vitamina C, es un enodiol de una lactona derivada del D-glucoronato. Los primates no pueden convertir glucoronato en ácido ascórbico, y en consecuencia deben obtenerlo en su dieta. El ácido ascórbico es un cofactor esencial para las enzimas que catalizan la hidroxilación de los residuos de prolina y lisina durante la síntesis de colágena.
Disacáridos y otros glicósidos
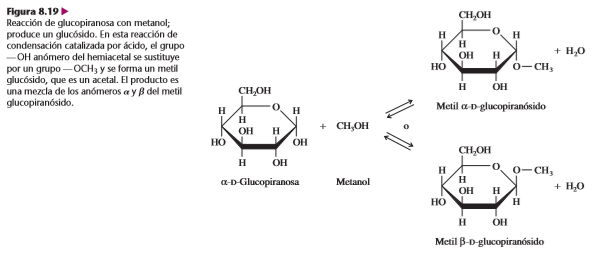
El enlace glicosídico es el principal enlace estructural en todos los polímeros de los monosacáridos. Es un enlace acetal, donde el carbono anomérico de un azúcar se condensa con un alcohol, una amina o un tiol. Los glucósidos son una clase especial de glicósidos, donde la glucosa aporta el carbono anomérico. Entre los glicósidos hay disacáridos, polisacáridos y algunos derivados de carbohidrato.
A. Estructuras de los disacáridos
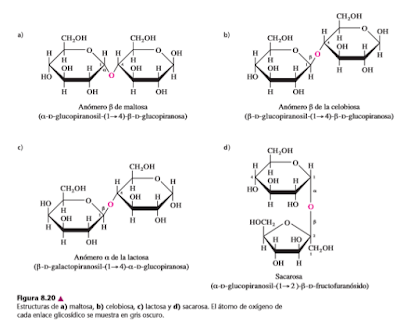
Los disacáridos se forman cuando el carbono anomérico de una molécula de azúcar interactúa con uno de varios grupos hidroxilo de la otra molécula de azúcar. Así, para los disacáridos y otros carbohidratos polímeros, se deben considerar los tipos de residuos de monosacárido que están presentes, y también los átomos que forman los enlaces glicosídicos. En la descripción sistemática de un disacárido, los átomos de enlace, se deben especificar la configuración del enlace glicosídico y el nombre de cada residuo de monosacárido (incluyendo su designación como piranosa o furanosa). La figura 8.20 presenta las estructuras y la nomenclatura de cuatro disacáridos comunes.
Como los monosacáridos y la mayor parte de los disacáridos son hemiacetales y en consecuencia contienen un grupo carbonilo reactivo, se oxidan con facilidad y forman productos diversos, propiedad que se usa con frecuencia para analizarlos. Esos carbohidratos, incluyendo glucosa, maltosa, celobiosa y lactosa, se llaman a veces azúcares reductores. Los azúcares reductores se detectaban por su capacidad de reducir iones metálicos, como o Ag y formar productos insolubles. Los carbohidratos que son acetales, como la sacarosa, no se oxidan con facilidad, porque ambos átomos de carbono anoméricos están fijos en un enlace glicosídico. Se clasifican como azúcares no reductores.
C. Nucleótidos y otros glicósidos
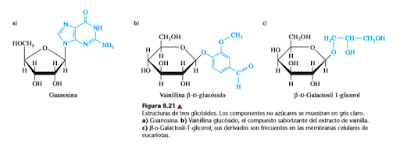
Los carbonos anoméricos de los azúcares forman enlaces glicosídicos no sólo con otros azúcares, sino también con diversos alcoholes, aminas y tioles. Los glicósidos que se encuentran con más frecuencia, además de los oligosacáridos y polisacáridos, son los nucleósidos, donde hay purina o pirimidina unida por su grupo amino secundario a una mitad de b-D-ribofuranosa o b-D-desoxirribofuranosa. Los nucleósidos se llaman N-glicósidos debido que en el enlace glicosídico particima un átomo de nitrógeno. La guanosina (b-D-ribofuranosilguanina) es un nucleósido típico (figura 8.21). Ya se ha descrito el ATP y otros nucleótidos que son coenzimas metabolito (sección 7.3); también el NAD y el FAD son nucleótidos.
En la figura 8.21 se ven otros dos ejemplos de glicósidos naturales. El vainillin glucósido (figura 8.2b) es el compuesto saborizante del extracto de vainilla natural. Los b-galactósidos son otra clase abundante de glicósidos. En esos compuestos se unen varias moléculas de no azúcar en enlace b con la galactosa. Por ejemplo, los galactocerebrósidos, derivados del b-D-galactosilo 1-glicerol (figura 8.21c) son glicolípidos comunes en las membranas de células eucariotas, y se pueden hidrolizar con facilidad por acción de las enzimas llamadas b-galactosidasas.
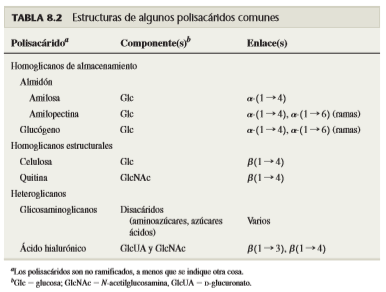
Con frecuencia se divide a los polisacáridos en dos clases extensas. Los homoglicanos (u homopolisacáridos) son polímeros que sólo contienen residuos de un tipo de monosacárido. Los heteroglicanos (o heteropolisacáridos) son polímeros que contienen residuos de más de un tipo de monosacárido. A diferencia de las proteínas, cuyas estructuras primarias se codifican por el genoma y tienen así longitudes específicas, los polisacáridos se forman sin una plantilla, por adición de determinados residuos de monosacárido y oligosacárido.
La mayor parte de los polisacáridos también se pueden clasificar de acuerdo con sus funciones biológicas. Por ejemplo, el almidón y el glucógeno son polisacáridos de almacenamiento, y la celulosa y la quitina son polisacáridos estructurales.
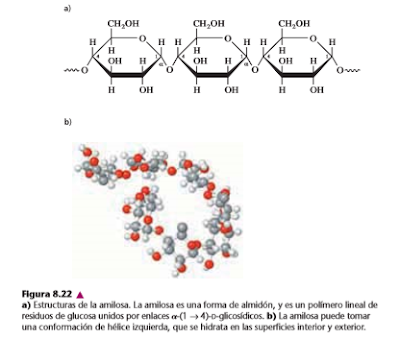
A. Almidón y glucógeno
Todas las especies sintetizan D-glucosa. El exceso de glucosa se puede descomponer y producir energía metabólica. Los residuos de glucosa se almacenan como polisacáridos, hasta que se necesitan para producir energía. El homoglicano de almacenamiento más común de la glucosa en las plantas y los hongos es el almidón; y en los animales es el glucógeno. Ambos tipos de polisacárido existen en las bacterias.
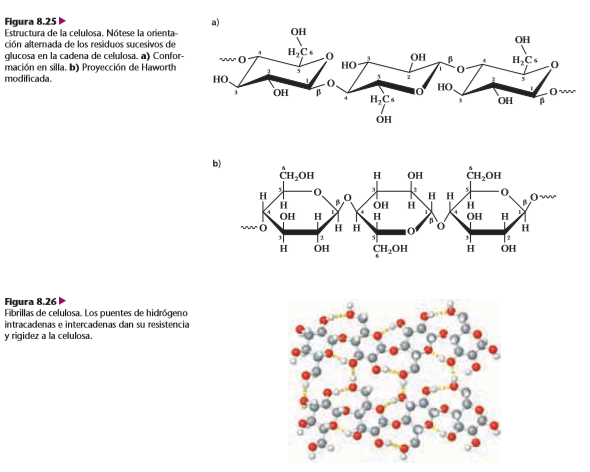
B. Celulosa y quitina
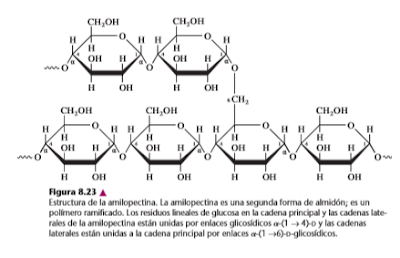
La celulosa es un polisacárido estructural. Es uno de los principales componentes de las paredes celulares rígidas que rodean muchas células vegetales. Los tallos y las ramas de muchas plantas están formados principalmente por celulosa. Este solo polisacárido forma un porcentaje apreciable de toda la materia orgánica en la Tierra.
La quitina, tal vez el segundo compuesto más abundante en la Tierra, es un homoglicano estructural que se encuentra en los exoesqueletos de los insectos y crustáceos, y también en las paredes celulares de la mayor parte de los hongos y en muchas algas. La quitina es un polímero lineal parecido a la celulosa. Está formado por residuos de GlcNAc unidos por b-(1→ 4), y no por residuos de glucosa (figura 8.27).
Vías metabólicas de los Carbohidratos
Se define como metabolismo de los carbohidratos a los
procesos bioquímicos de formación, ruptura y conversión de los carbohidratos en
los organismos vivos. Los carbohidratos son las principales moléculas
destinadas al aporte de energía, gracias a su fácil metabolismo.
 La gluconeogénesis es la producción de nueva glucosa. Si la
molécula no es necesitada inmediatamente se almacena bajo la forma de
Glucógeno. Generalmente en personas con requerimientos de glucosa bajos (poca
actividad física), el glucógeno se encuentra almacenado en el hígado pero este
puede ser utilizado y metabolizado por 2 enzimas: la enzima desramificante y la
glucógeno fosforilasa. El proceso de gluconeogénesis se hace de muchas formas
posibles, siendo las tres más importantes.
La gluconeogénesis es la producción de nueva glucosa. Si la
molécula no es necesitada inmediatamente se almacena bajo la forma de
Glucógeno. Generalmente en personas con requerimientos de glucosa bajos (poca
actividad física), el glucógeno se encuentra almacenado en el hígado pero este
puede ser utilizado y metabolizado por 2 enzimas: la enzima desramificante y la
glucógeno fosforilasa. El proceso de gluconeogénesis se hace de muchas formas
posibles, siendo las tres más importantes.
Desde glicerol
El proceso empieza cuando el glicerol (que viene desde el
proceso de lipolisis) se fosforila para obtener así el glicerol 3 fosfato. Este
proceso es catalizado por la enzima Glicerol Quinasa, el glicerol 3 fosfato se
convierte en dihidroxiacetona fosfato (producto que también participa en la
ruta anterior), este proceso es catalizado por la glicerol 3 fosfato
óxido-reductasa, la dihidroxiacetona fosfato se convierte en fructuosa 1,6
bisfofato, ésta pasa a glucosa 6 fosfato por otra enzima (recordemos que este
proceso es regulado por lo tanto tendría que regresar por una enzima más
específica para este sustrato), la glucosa 6 fosfato se convierte en glucosa
por medio de la Glucosa 6 Fosfatasa y así puede ser liberada a sangre en
tejidos hipoglucemias como el hígado.
Desde acidos grasos (lipidos)
El mecanismo empieza cuando los ácidos grasos, mediante el
proceso de lipidolísis, se degradan hasta propionato, luego éste mediante una
serie de reacción ingresa al ciclo de Krebs con ayuda de la molécula de Succinil
S Coa (coenzima A) y luego pasa a fumarato, luego a malato y es ahí en donde se
produce un pequeño inconveniente; la membrana de la mitocondria no es permeable
para malato. Debido a esto es que se tiene la respuesta a la pregunta de 'por
qué es tan difícil bajar de peso'. Al no ser permeable a malato la célula tiene
que ingeniársela para sacar esta molécula, así que la saca bajo la forma de
oxal acetato en donde se producen las reacción anteriores hasta llegar a la
glucosa.
Desde láctico
El desplazamiento de las moléculas de lactato y piruvato (en
condiciones de requerimiento de energía) esta hacia piruvato esto es realizado
por la enzima lactato dehidrogenasa, desde pirúvico es casi imposible detener
el proceso y este se carboxila (mediante la piruvato carboxilasa) para poder
entrar a la mitocondria como oxal acetato. El oxal acetato pasa a Malato
mediante la malato deshidrogenasa de tipo A, deacargando su protones sobre el
NAD+, el Malato vuelve a Oxal acetato pero fuera de La mitocondria (debido a lo
explicado anteriormente, de que el Malato no es permeable en mitocondria),
mediante la malato deshidrogenasa tipo b, este pasa a Fosfo enol piruvato
mediante la Fosfo enol Piruvato carboxi quinasa, para empezar nuevamente el
proceso de Gluconeogenesis.
Uso de los Carbohidratos en la Farmacia
El almidón y la pectina, un agente cuajante, se usan en la
preparación de alimentos para el hombre y el ganado. La goma arábiga se usa en
medicamentos demulcentes. El agar, un componente de algunos laxantes, se
utiliza como agente espesante en los alimentos y como medio para elcultivo
bacteriano; también en la preparación de materiales adhesivos, de encolado y
emulsiones.
Los dextranos son polisacáridos utilizados en medicina como
expansores de volumen del plasma sanguíneo para contrarrestar las conmociones
agudas. Otro hidrato de carbono, el sulfato de heparina, es unanticoagulante de
la sangre.
Gelificantes, Espesante y estabilizantes
Las substancias capaces de formar geles se han utilizado en la producción de alimentos elaborados desde hace mucho tiempo. Entre las sustancias capaces de formar geles está el almidón y la gelatina, El almidón actua muy bien como espesante en condiciones normales, pero tiene tendencia a perder líquido cuando el alimento se congela y se descongela. Algunos derivados del almidón tienen mejores propiedades que éste, y se utilizan también. Los derivados del almidón son nutricionalmente semejantes a él, aportando casi las mismas calorías.
Este es un tipo de gel que se utiliza como suplemento
alimenticio que contiene carbohidratos (para dar energia), minerales y vitamina
C.
El objetivo de los geles energéticos es proveer en un
pequeño envase fácil de transportar una gran cantidad de carbohidratos y
electrolitos útiles para reponer energía en forma instantánea. Esto puede
realizarse siempre y cuando la persona pueda incorporar agua en cantidad adecuada.
PULVER formuló geles de 40 gramos con 27 gramos de carbohidratos que llegan al
estómago en forma inmediata pero que si no reciben agua se absorben lentamente
produciendo molestias. En cambio con agua se absorben rápidamente con la
inmediata sensación de energía y recuperación.
 Pertenece al grupo de medicamentos emolientes y
protectores que contienen zinc. Combina la acción protectora del óxido de zinc
y del almidón; el primero absorbe la humedad y tiene un ligero efecto
astringente (cicatrizante) y antiséptico (antiinfeccioso) moderado.
Pertenece al grupo de medicamentos emolientes y
protectores que contienen zinc. Combina la acción protectora del óxido de zinc
y del almidón; el primero absorbe la humedad y tiene un ligero efecto
astringente (cicatrizante) y antiséptico (antiinfeccioso) moderado.
 Composición: Comprimidos: Cada comprimido contiene:
Picosulfato de Sodio 5 mg. Excipientes:
Almidón de Maíz, Almidón Hidrolizado, Almidón Soluble, Estearato de Magnesio,
Acido Silícico Coloidal y Lactosa c.s. Gotas: Cada 1 ml (= 15 gotas) de la
solución para gotas orales contiene: Picosulfato de Sodio 7.5 mg. Excipientes:
Benzoato de Sodio, Citrato de Sodio Dihidratado, Sorbitol, Acido Cítrico
Monohidrato y Agua Purificada c.s. Cápsulas blandas: Cada cápsula blanda
contiene: Picosulfato de Sodio 2.5 mg. Excipientes: Macrogol 400,
Propilenglicol, Agua Purificada, Gelatina y Glicerol c.s.
Composición: Comprimidos: Cada comprimido contiene:
Picosulfato de Sodio 5 mg. Excipientes:
Almidón de Maíz, Almidón Hidrolizado, Almidón Soluble, Estearato de Magnesio,
Acido Silícico Coloidal y Lactosa c.s. Gotas: Cada 1 ml (= 15 gotas) de la
solución para gotas orales contiene: Picosulfato de Sodio 7.5 mg. Excipientes:
Benzoato de Sodio, Citrato de Sodio Dihidratado, Sorbitol, Acido Cítrico
Monohidrato y Agua Purificada c.s. Cápsulas blandas: Cada cápsula blanda
contiene: Picosulfato de Sodio 2.5 mg. Excipientes: Macrogol 400,
Propilenglicol, Agua Purificada, Gelatina y Glicerol c.s.
Anticongestiva Cusí (Pasta Lassar) Pasta cutánea
Usos: Anticongestiva Cusí está indicada para protección y
alivio temporal de afecciones irritativas leves de la piel, como las
siguientes:
Escoceduras, irritaciones y erosiones superficiales de la
piel provocadas por: quemaduras leves o superficiales, eritema solar,
intértrigo (inflamación de los pliegues de la piel).
Posibles efectos adversos: Podrían producirse los siguientes efectos
adversos, con frecuencia no conocida exactamente:
Manifestaciones de tipo alérgico, irritación local, picor
o escozor. En estos casos, se debe suspender el tratamiento y lavar la zona
afectada con agua.
Otros: sequedad de la piel y, con el uso prolongado,
aumento de los restos de la lesión, con aumento de las molestias.
Si experimenta efectos adversos, consulte a su médico o
farmacéutico, incluso si se trata de efectos adversos que no aparecen en este
prospecto.
Dulcolax
 Composición: Comprimidos: Cada comprimido contiene:
Picosulfato de Sodio 5 mg. Excipientes:
Almidón de Maíz, Almidón Hidrolizado, Almidón Soluble, Estearato de Magnesio,
Acido Silícico Coloidal y Lactosa c.s. Gotas: Cada 1 ml (= 15 gotas) de la
solución para gotas orales contiene: Picosulfato de Sodio 7.5 mg. Excipientes:
Benzoato de Sodio, Citrato de Sodio Dihidratado, Sorbitol, Acido Cítrico
Monohidrato y Agua Purificada c.s. Cápsulas blandas: Cada cápsula blanda
contiene: Picosulfato de Sodio 2.5 mg. Excipientes: Macrogol 400,
Propilenglicol, Agua Purificada, Gelatina y Glicerol c.s.
Composición: Comprimidos: Cada comprimido contiene:
Picosulfato de Sodio 5 mg. Excipientes:
Almidón de Maíz, Almidón Hidrolizado, Almidón Soluble, Estearato de Magnesio,
Acido Silícico Coloidal y Lactosa c.s. Gotas: Cada 1 ml (= 15 gotas) de la
solución para gotas orales contiene: Picosulfato de Sodio 7.5 mg. Excipientes:
Benzoato de Sodio, Citrato de Sodio Dihidratado, Sorbitol, Acido Cítrico
Monohidrato y Agua Purificada c.s. Cápsulas blandas: Cada cápsula blanda
contiene: Picosulfato de Sodio 2.5 mg. Excipientes: Macrogol 400,
Propilenglicol, Agua Purificada, Gelatina y Glicerol c.s.
Acción Terapéutica: Laxante fisiológico.
Indicaciones:
Indicado para el tratamiento del estreñimiento y para facilitar la evacuación
intestinal.
Posología:
Se recomienda comenzar con la dosis más baja. La dosis puede ajustarse hasta
llegar a la dosis máxima recomendada para lograr deposiciones regulares. No
debe excederse la dosis diaria máxima recomendada. Comprimidos: Adultos y niños
> 10 años: 1- 2 comprimidos (5 - 10 mg) en la noche. Niños de 4 -10 años: ½
- 1 comprimido (2.5 - 5 mg) en la noche. Gotas: Adultos y niños > 10 años:
10 - 20 gotas (5 - 10 mg) en la noche. Niños de 4 -10 años: 5 - 10 gotas (2.5 -
10 mg) en la noche.
Hestar
Dosis
y vía de administración: La vía de administración de HESTAR® es
por infusión intravenosa.
Para la expansión del
volumen plasmático: HESTAR® a 6 y 10% deberá administrarse únicamente mediante
infusión intravenosa. La dosis total y la velocidad de administración dependen
de la cantidad de sangre o plasma perdidos y la hemoconcentración resultante.
Contraindicaciones:
HESTAR® está contraindicado en pacientes con hipersensibilidad al almidón o a
los componentes de la fórmula, o con alteraciones sanguíneas (de coagulación),
o con insuficiencia cardiaca congestiva en donde la sobrecarga es un problema
potencial. También está contraindicado su uso en pacientes con padecimientos
renales que presentan oliguria o anuria no relacionadas con hipovolémia
(creatinina mayor a 177 mmol/L).
Reacciones
secundarias y adversas: Han sido reportadas las siguientes
reacciones adversas: vómito, fiebre, calosfríos, prurito, aumento del volumen
de las glándulas submaxilares y parótidas, síndrome seudogripal, cefalea,
mialgias, edema periférico en piernas, reacciones anafilactoides (edema
periorbitario, urticaria, disnea) y cuando se administran grandes dosis,
sangrado debido a la hemodilución, sobrecarga circulatoria y edema pulmonar.
Restricciones de uso durante
el embarazo y la lactancia: Debido a que no se han realizado
estudios bien controlados durante el embarazo, se recomienda usar HESTAR®
únicamente cuando los beneficios superen con claridad los riesgos potenciales.
Se desconoce si el pentalmidón se excreta en la leche materna.